Como acabamos de ver en la introducción del punto denominado "Ecuación de velocidad", la velocidad de una reacción, en general, dependerá de la concentración de reactivo que en cada momento hay. En la siguiente simulación podemos ver la representación de la concentración de reactivo de la reacción anterior en función del tiempo y al lado la representación de la velocidad en función del tiempo.
Escena. Variación de la velocidad en función del tiempo
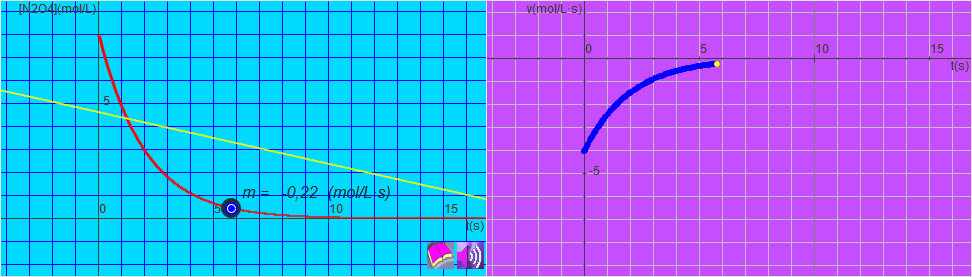
Como acabas de ver en la simulación anterior, la velocidad de una reacción depende de la concentración de reactivo que va quedando. Para una reacción de este tipo ![]() , la ecuación de la velocidad será:
, la ecuación de la velocidad será:
![]()
Donde k es la llamada constante cinética (que depende del tipo de reacción y de la temperatura) y alfa y beta son los órdenes parciales de la reacción respecto de A y de B. Los órdenes parciales no coinciden, en general, con la estequiometría de la reacción. Lógicamente, las unidades de k dependerán de los órdenes de la reacción.
Se llama orden total de la reacción a la suma de todos los órdenes parciales de la reacción, en este caso sería ![]() .
.
Un modo de proceder en el laboratorio para calcular los órdenes parciales de una reacción es mantener las concentraciones de todos los reactivos (excepto la del reactivo cuyo orden pretendemos conocer) constantes y observar a intervalos de tiempo regulares la concentración del reactivo en estudio (véase el siguiente punto).