Reacción de segundo orden, teniendo en cuenta que la ecuación integrada es:
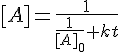
Al representar la inversa de la concentración en función del tiempo, obtendremos una recta cuya pendiente sería la constante cinética cuya ordenada en el origen sería la inversa de la concentración inicial.
Reacciones con más de un reactivo
Si en la reacción interviene más de un reactivo, el estudio se hace manteniendo las concentraciones de todos los reactivos, excepto uno, constantes (usando una gran cantidad de éstos) y anotando la evolución de la concentración del reactivo en estudio respecto del tiempo.
Por ejemplo, imaginemos que queremos determinar la constante cinética y los órdenes parciales en la siguiente reacción:
I2 + H2 → 2 HI
Podríamos usar una concentración inicial para el I2 de 0.01 M y para el H2 de 0.5 M (su concentración se va a mantener prácticamente constante a lo largo de la reacción). Estudiaríamos la evolución de la concentración de I2 con el tiempo y haríamos las gráficas para determinar el orden parcial respecto del I2. Posteriormente haríamos lo contrario, mantendríamos constante la concentración de I2 (por ejemplo usando una concentracón inicial de 0.5 M) y usando una concentración inicial para el H2 mucho menor (por ejemplo, 0.01 M) después, analizaríamos la evolución de la concentración de H2 en función del tiempo.