En este caso:
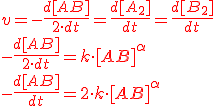
La mejor estrategia para determinar la constante cinética y el orden de la reacción es representar los datos de la tabla y reflexionar sobre cuál debe ser el orden de la reacción comparando esta gráfica con gráficas ya elaboradas de reacciones de orden cero, primer orden, segundo orden, tercer orden...
Cuando se representa la concentración de AB en función del tiempo se obtiene una gráfica como la siguiente:
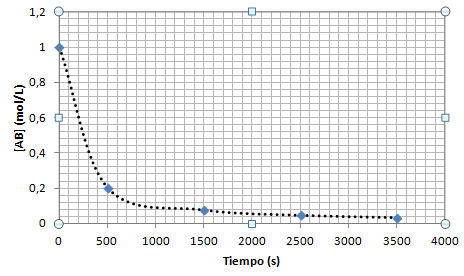
Este gráfico sugiere que la cinética es de segundo orden (orden de la reacción, 2). Para confirmarlo, podemos representar el tiempo en función de 1/[AB]:
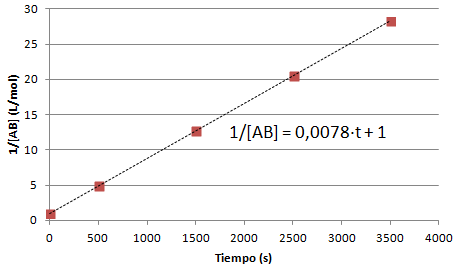
La pendiente de esta recta será dos veces la constante cinética, por tanto k = 0.0039 L·mol/s.
La ley de la cinética de esta reacción es, por tanto:
v = 0.0039 · [AB]2