El mecanismo de una reacción química es el conjunto de pasos sencillos que se dan en la misma. Por ejemplo en la reacción:
CO + NO2 → NO + CO2
Los experimentos indican que esta reacción tiene lugar según la ley v = k [NO2]2. Un mecanismo posible para la reacción global que explica la ley sería:
1º Paso: 2 NO2 → NO3 + NO (lento)
2º Paso: NO3 + CO → NO2 + CO2 (rápido)
La molecularidad es el número de átomos, iones o moléculas que chocan simultáneamente en una reacción química. Como es evidente, será siempre un número entero. En el ejemplo anterior la molecularidad del primer paso sería de dos (reacción bimolecular) y la del segundo paso, también.
En el caso de un paso elemental, sus coeficientes estequiométricos sí que coinciden con los órdenes parciales de la reacción, podríamos escribir las leyes de velocidad para los pasos elementales anteriores así:
1º Paso: 2 NO2 → NO3 + NO (lento); v1=k1[NO2]2
2º Paso: NO3 + CO → NO2 + CO2 (rápido); v2=k2[NO3]·[CO]
En el mecanismo de una reacción nos interesa saber cuál es la molecularidad del paso más lento, ya que es éste el que tiene importancia para el cálculo de los órdenes de la reacción global.
Para reacciones sencillas, la molecularidad puede ser obtenida a partir de la estequiometría de la ecuación química. Así, en la reacción anterior, el paso que determinará el orden de la reacción es el primero (más lento) de modo que la ley de velocidad de la reacción global sería:
v = k[NO2]2
En una reacción de descomposición simple, la molecularidad es uno, reacción unimolecular, por ejemplo la transposición del cis-buteno:
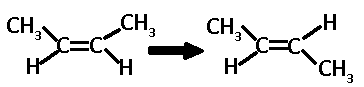
En la transposición del cis-buteno a trans-buteno únicamente interviene una molécula (el doble enlace se rompe y el grupo metilo rota en torno al enlace sencillo, posteriormente se vuelve a formar el doble enlace.