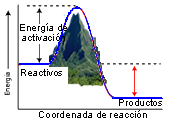
La energía de activación es la energía que se debe superar para que dos moléculas reaccionen. Aquí se muestra para una reacción exotérmica.
La gran variedad de especies químicas, tipos de reacciones y la energía potencial implicada hace que los tiempos en las reacciones químicas cubran un amplio espectro de órdenes de magnitud, desde reacciones muy lentas, como la oxidación del cobre; a las más rápidas, como la combustión.
El estudio de la cinética de una reacción química normalmente se lleva a cabo con uno o ambos de los dos principales objetivos en mente:
- Determinación de la velocidad de la reacción completa y/o la de sus pasos elementales.
- Análisis de la secuencia de pasos elementales que dan lugar a la reacción global. Es decir el llamado mecanismo de reacción.