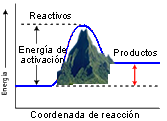
Como regla general, los procesos elementales implican una transición entre dos estados separados por una barrera de energía potencial. Esta barrera la constituye la llamada energía de activación del proceso y determina la velocidad a la que se produce. Cuando la barrera es baja, la energía térmica de los reactivos será suficiente para superarla y convertirse en productos, y la reacción será rápida. No obstante, cuando la barrera sea alta, sólo unas pocas moléculas de los reactivos tendrán la energía suficiente para traspasarla y, en consecuencia, la reacción será lenta. Como la energía térmica de las moléculas está relacionada con su velocidad, podemos adivinar que la temperatura será decisiva a la hora de determinar si se supera o no dicha barrera de potencial. Por consiguiente, la temperatura estará relacionada con la velocidad de la reacción.