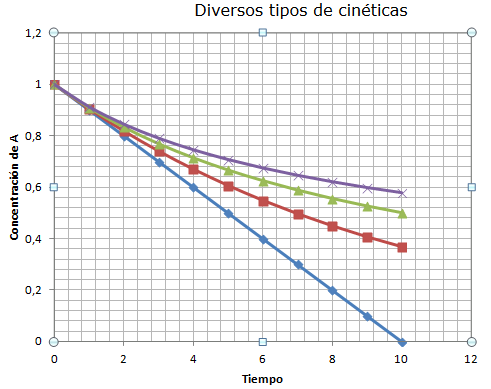
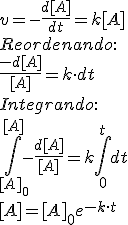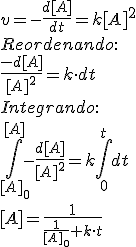Una manera de estudiar la cinética de una reacción es el estudio de la ecuación integrada de la velocidad. Como hemos visto, la ecuación de la velocidad de una reacción depende de la constante cinética, de la concentración de reactivos existente y del orden de la reacción. Vamos a estudiar ahora las leyes que seguiría la concentración de un reactivo en función del tiempo según que los órdenes de la reacción sean 0, 1 ó 2.
| Cinética de orden cero | Cinética de primer orden: | Cinética de segundo orden: | Gráficas |
|
|
|
|
Pulsa sobre la imagen para ampliarla |
Cuando se usa este método, si hay más de un reactivo se estudia la variación de la concentración de uno de ellos mientras se mantienen constantes las del resto de reactivos (con una gran concentración de estos).