Ya sabemos que si vertemos una sal sobre una disolución saturada de la misma, se establecerá un equilibrio (dinámico) entre la fase sólida y la líquida. Por tanto, cualquier modificación hará que el equilibrio se desplace para compensar dicha modificación.
Supongamos que a un equilibrio como el anterior añadimos una especie química que reacciona con uno de los productos para dar un ión complejo, el equilibrio se desplazará hacia la derecha disolviéndose más precipitado. Esto es lo que ocurre cuando añadimos amoníaco a una disolución saturada de cloruro de plata en equilibrio con el precipitado:
| En agua destilada |
AgCl(s)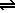 Ag+(ac) + Cl-(ac) Ag+(ac) + Cl-(ac) |
Ks =1.7·10-10 |
| |
1.30·10-5M |
|
1.30·10-5M |
|
| |
| Al añadir amoníaco |
Ag+ + 2 NH3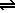 [Ag·2NH3]+ [Ag·2NH3]+ |
|


