|
|
Hay reacciones en las que los productos obtenidos son estables y no reaccionan entre sí para dar de nuevo los reactivos. Decimos que estas reacciones son irreversibles. Normalmente representamos este tipo de reacciones con una ecuación química donde separamos los reactivos de los productos mediante una flecha unidireccional:
2H2(g) + O2(g) → 2 H2O(g)
|
Pero también hay reacciones en las que los productos reaccionan entre sí para volver a dar reactivos y que, por tanto, no conducen a una desaparición total de los reactivos. Este tipo de reacciones se llaman reversibles y sus ecuaciones químicas se representan con una doble flecha:
N2O4(g) 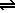 2 NO2(g) 2 NO2(g) |

Los contenidos de esta unidad didáctica están bajo una licencia de Creative Commons si no se indica lo contrario.
|


