En el apartado anterior acabamos de ver que muchos procesos exotérmicos son espontáneos; sin embargo, existen muchos procesos endotérmicos espontáneos como la disolución de la mayoría de sales en agua, la fusión de un trozo de hielo a temperatura superior a 0 ºC, la evaporación del acohol etílico a 30 ºC... En todos estos procesos aumenta el grado de desorden, por tanto, necesitaremos un criterio que incorpore la variación de la entropía del sistema para discernir si un proceso será espontáneo o no.
Recordemos que cuando estudiamos la magnitud llamada entropía vimos que, sea cual sea el proceso considerado, la entropía del universo siempre aumenta:
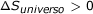
Podemos tomar este hecho como base para establecer una nueva magnitud que, referida únicamente a las variables del sistema, nos permita determinar si un proceso será espontáneo o no.
Para definir esta nueva magnitud, vamos a examinar un proceso hipotético que se produce a temperatura y presión constantes. Este proceso va acompañado de un efecto calorífico a presión constante, la variación de entalpía (ΔHSistema). El efecto calorífico experimentado por los alrededores es el opuesto al del sistema: QEntorno= -ΔHSistema. Además, si el entorno es suficientemente grande, el proceso por el que el calor entra o sale del entorno puede hacerse reversible. Es decir, puede hacerse que la cantidad de calor produzca sólo un cambio infinitesimal en la temperatura del entorno. En este caso, la variación de entropía en el entorno es ΔSEntorno = -ΔHSistema/T. Como en un proceso espontáneo:
|


