La electrolisis es el proceso inverso al llevado a cabo en una pila eléctrica; es decir, conseguir producir una reacción redox no espontánea utilizando energía eléctrica.
La electrolisis se puede producir haciendo pasar una intensidad de corriente por una disolución de un electrolito (compuesto iónico, ácidos, bases...) o por una cubeta con el electrolito fundido.
Una cuba electrolítica consiste en un recipiente con el electrolito fundido o disuelto en la que se introducen dos electrodos inertes (de grafito, platino...) conectados a una fuente de corriente eléctrica continua. Al contrario que en las pilas eléctricas, al electrodo positivo se le denomina ánodo y al negativo cátodo.
Podemos producir la electrolisis del agua (gracias a su autoionización, H2O 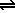 OH- + H+). La electrolisis del agua aumenta su eficacia si añadimos un poco de electrolito a la misma. Los procesos que se llevan a cabo en los electrodos son: OH- + H+). La electrolisis del agua aumenta su eficacia si añadimos un poco de electrolito a la misma. Los procesos que se llevan a cabo en los electrodos son:
(+) Ánodo: 4OH- → O2 + 2H2O + 4e-
(-) Cátodo: 4H+ + 4e- → 2H2
|


