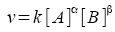|
De acuerdo con la teoría de colisiones, para que se produzca una reacción química tienen que chocar entre sí las moléculas reaccionantes. El número de choques será proporcional a la concentración de cada uno de los reactivos. Este hecho viene recogido en la expresión de la ecuación de velocidad, ya que ésta es proporcional a las concentraciones elevadas a su orden de reacción.
En reacciones entre gases, la velocidad de reacción depende de la presión a que se ven sometidos los reactivos y puede deducirse experimentalmente que al aumentar la presión parcial de los gases aumenta la velocidad de reacción. La presión es proporcional al número de moléculas, por lo que si aumentamos la presión aumentaremos los choques entre las moléculas y con ello la velocidad de reacción.
En aquellas reacciones donde se aplica un exceso de reactivo, aunque no se consiga aumentar la cantidad total de producto, se consigue un aumento de velocidad al haber una mayor concentración de reactivo, o una mayor presión.
|