|
Una modificación de la teoría de colisiones fue enunciada por H. Eyring en 1835, que completa la anterior teoría. Esta modificación se conoce como teoría del estado de transición o del complejo activado.
Según esta teoría la reacción transcurre a través de un intermedio, complejo activado, formado por moléculas que han chocado y en el que algunos enlaces se han relajado y se han empezado a formar otros. En este estado la energía del complejo es elevada, por lo que es inestable, y rápidamente se descompone formando los productos de reacción.
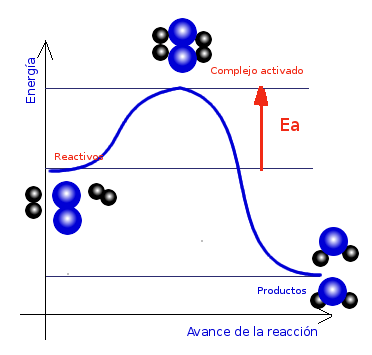 La formación del complejo activado supone que hay que remontar una barrera energética para que la reacción transcurra.
La energía necesaria para pasar desde los reactivos al estado de transición se llama energía de activación.
Si la energía de activación es baja habrá muchas moléculas que superen esta barrera y la reacción será rápida. La formación del complejo activado supone que hay que remontar una barrera energética para que la reacción transcurra.
La energía necesaria para pasar desde los reactivos al estado de transición se llama energía de activación.
Si la energía de activación es baja habrá muchas moléculas que superen esta barrera y la reacción será rápida.
Por otra parte, aunque la reacción sea exotérmica, si la energía de activación es alta, habría muy pocas moléculas que las superen y es necesario dar a los reactivos una cantidad de energía mínima para que la reacción se inicie. Una vez iniciada el calor de reacción es suficiente para mantener la reacción.
| 

