Preguntas y problemas - Capítulo III
3.1 Fórmula de masa y el concepto de mole
- ¿Cuál es la masa total (uma) de carbono en cada una de las siguientes moléculas?
- CH4
- CHCl3
- C12H10O6
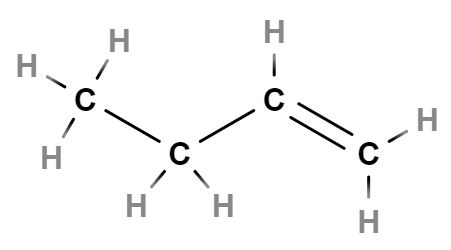
- CH3CH2CH2CH2CH3
- ¿Cuál es la masa total de hidrógeno en cada una de las moléculas?
- CH4
- CHCl3
- C12H10O6
- CH3CH2CH2CH2CH3
- Calcule la masa molecular o de fórmula de cada uno de los siguientes:
- P4
- H2O
- Ca(NO3)2
- CH3CO2H (ácido acético)
- C12H22O11 (sacarosa, azúcar de caña)
- Determine la masa molecular de los siguientes compuestos:
a.
b.
c.
d.
- Determine la masa molecular de los siguientes compuestos:
a.
b.
c.
d.
- ¿Qué molécula tiene una masa molecular de 28,05 uma?
a.
b.
c.
- Escribe una oración que describa cómo determinar el número de moles de un compuesto en una masa conocida del compuesto usando su fórmula molecular.
- Compara 1 mol de H2, 1 mol de O2 y 1 mol de F2.
- ¿Cuál tiene el mayor número de moléculas? Explicar por qué.
- ¿Cuál tiene la mayor masa? Explicar por qué.
- ¿Cuál contiene la mayor masa de oxígeno: 0.75 mol de etanol (C2H5OH), 0.60 mol de ácido fórmico (HCO2H) o 1.0 mol de agua (H2O)? Explicar por qué.
- ¿Cuál contiene el mayor número de moles de átomos de oxígeno: 1 mol de etanol (C2H5OH), 1 mol de ácido fórmico (HCO2H) o 1 mol de agua (H2O)? Explicar por qué.
- ¿En qué se parecen la masa molecular y la masa molar de un compuesto y en qué se diferencian?
- Calcule la masa molar de cada uno de los siguientes compuestos:
- fluoruro de hidrógeno, HF
- amoniaco, NH3
- ácido nítrico, HNO3
- sulfato de plata, Ag2SO4
- ácido bórico, B(OH)3
- Calcula la masa molar de cada uno de los siguientes:
- S8
- C5H12
- Sc2(SO4)3
- CH3COCH3 (acetona)
- C6H12O6 (glucosa)
- Calcule la masa de fórmula empírica o molecular y la masa molar de cada uno de los siguientes minerales:
- piedra caliza, CaCO3
- halita, NaCl
- berilo, Be3Al2Si6O18
- malaquita, Cu2(OH)2CO3
- turquesa, CuAl6(PO4)4(OH)8(H2O)4
- Calcula la masa molar de cada uno de los siguientes:
- El halotano anestésico, C2HBrClF3.
- el herbicida paraquat, C12H14N2Cl2
- cafeína, C8H10N4O2
- urea, CO(NH2)2
- un jabón típico, C17H35CO2Na
- Determine el número de moles de compuesto y el número de moles de cada tipo de átomo en cada uno de los siguientes:
- 25.0 g de propileno, C3H6
- 3.06 × 10−3 g del aminoácido glicina, C2H5NO2
- 25 lb del herbicida Treflan, C13H16N2O4F (1lb = 454g)
- 0.125 kg del insecticida Paris Green, Cu4(AsO3)2(CH3CO2)2
- 325 mg de aspirina, C6H4(CO2H)(CO2CH3)
- Determine la masa de cada uno de los siguientes:
- 0.0146 mol KOH
- 10,2 mol de etano, C2H6
- 1,6 × 10−3 mol de Na2SO4
- 6.854 × 103 mol de glucosa, C6H12O6
- 2,86 mol de Co(NH3)6Cl3
- Determine el número de moles del compuesto y el número de moles de cada tipo de átomo en cada uno de los siguientes:
- 2.12 g de bromuro de potasio, KBr
- 0.1488 g de ácido fosfórico, H3PO4
- 23 kg de carbonato de calcio, CaCO3
- 78.452 g de sulfato de aluminio, Al2(SO4)3
- 0.1250 mg de cafeína, C8H10N4O2
- Determine la masa de cada uno de los siguientes:
- 2.345 mol de LiCl
- 0.0872 mol de acetileno, C2H2
- 3.3 × 10−2 mol Na2CO3
- 1.23 × 103 mol fructosa, C6H12O6
- 0.5758 mol de FeSO4(H2O)7
- El requerimiento dietético mínimo diario aproximado del aminoácido leucina, C6H13NO2, es de 1.1 g. ¿Cuál es este requisito en moles?
- Determine la masa en gramos de cada uno de los siguientes:
- 0.600 mol de átomos de oxígeno.
- 0.600 mol de moléculas de oxígeno, O2
- 0.600 mol de moléculas de ozono, O3
- Una mujer de 55 kg tiene 7.5 × 10−3 mol de hemoglobina (masa molar = 64,456 g / mol) en su sangre. ¿Cuántas moléculas de hemoglobina es esta? ¿Cuál es esta cantidad en gramos?
- Determine la cantidad de átomos y la masa de circonio, silicio y oxígeno que se encuentra en 0.3384 moles de circón, ZrSiO4, una piedra semipreciosa.
- Determine cuál de las siguientes contiene la mayor masa de hidrógeno: 1 mol de CH4, 0,6 mol de C6H6 o 0,4 mol de C3H8.
- Determine cuál de los siguientes contiene la mayor masa de aluminio: 122 g de AlPO4, 266 g de Al2Cl6 o 225 g de Al2S3.
- El diamante es una forma de carbono elemental. Un anillo de compromiso contiene un diamante que pesa 1,25 quilates (1 quilate = 200 mg). ¿Cuántos átomos están presentes en el diamante?
- El diamante Cullinan fue el diamante natural más grande jamás encontrado (25 de enero de 1905). Pesaba 3104 quilates (1 quilate = 200 mg). ¿Cuántos átomos de carbono estaban presentes en la piedra?
- Una porción de 55 gramos de un cereal en particular proporciona 270 mg de sodio, 11% de la cantidad diaria recomendada. ¿Cuántos moles y átomos de sodio hay en la cantidad diaria recomendada?
- Un cierto cereal crujiente de nueces contiene 11.0 gramos de azúcar (sacarosa, C12H22O11) por porción de 60.0 gramos. ¿Cuántas porciones de este cereal se deben comer para consumir 0.0278 moles de azúcar?
- Un tubo de pasta de dientes contiene 0,76 g de monofluorofosfato de sodio (Na2PO3F) en 100 ml.
- ¿Qué masa de átomos de flúor en mg estaba presente?
- ¿Cuántos átomos de flúor estaban presentes?
- ¿Cuál de los siguientes representa el menor número de moléculas?
- 20.0 g de H2O (18.02 g / mol)
- 77.0 g de CH4 (16.06 g / mol)
- 68.0 g de CaH2 (42.09 g / mol)
- 100.0 g de N2O (44.02 g / mol)
- 84.0 g de HF (20.01 g / mol)
3.2 Determinación de fórmulas empíricas y moleculares
- ¿Qué información se necesita para determinar la fórmula molecular de un compuesto a partir de la fórmula empírica?
- Calcula lo siguiente a cuatro cifras significativas:
- la composición porcentual de amoníaco, NH3
- el porcentaje de composición de la solución de fijador fotográfico ("hipo"), Na2S2O3
- el porcentaje de ión calcio en Ca3(PO4)2
- Determine lo siguiente a cuatro cifras significativas:
- el porcentaje de composición del ácido hidrazoico, HN3
- el porcentaje de composición de TNT, C6H2(CH3)(NO2)3
- el porcentaje de SO42– en Al2(SO4)3
- Determine el porcentaje de amoníaco, NH3, en Co(NH3)6Cl3, a tres cifras significativas.
- Determine el porcentaje de agua en CuSO4∙5H2O a tres cifras significativas.
- Determine las fórmulas empíricas para compuestos con las siguientes composiciones porcentuales:
- 15.8% de carbono y 84.2% de azufre.
- 40.0% de carbono, 6.7% de hidrógeno y 53.3% de oxígeno
- Determine las fórmulas empíricas para compuestos con las siguientes composiciones porcentuales:
- 43.6% de fósforo y 56.4% de oxígeno.
- 28.7% K, 1.5% H, 22.8% P y 47.0% O
- Un compuesto de carbono e hidrógeno contiene 92.3% de C y tiene una masa molar de 78.1 g / mol. ¿Cuál es su fórmula molecular?
- El dicloroetano, un compuesto que se usa a menudo para la limpieza en seco, contiene carbono, hidrógeno y cloro. Tiene una masa molar de 99 g / mol. El análisis de una muestra muestra que contiene 24.3% de carbono y 4.1% de hidrógeno. ¿Cuál es su fórmula molecular?
- Determine la fórmula empírica y molecular para el amianto crisotilo. El crisotilo tiene la siguiente composición porcentual: 28,03% de Mg, 21,60% de Si, 1,16% de H y 49,21% de O. La masa molar para el crisotilo es de 520,8 g / mol.
- Los polímeros son moléculas grandes compuestas de unidades simples repetidas muchas veces. Por lo tanto, a menudo tienen fórmulas empíricas relativamente simples. Calcula las fórmulas empíricas de los siguientes polímeros:
- Lucite (Plexiglas); 59.9% C, 8.06% H, 32.0% O
- Saran; 24.8% C, 2.0% H, 73.1% Cl
- polietileno; 86% C, 14% H
- poliestireno; 92,3% C, 7,7% H
- Orlon; 67.9% C, 5.70% H, 26.4% N
- Un importante fabricante de tinte textil desarrolló un nuevo tinte amarillo. El colorante tiene una composición porcentual de 75,95% de C, 17,72% de N y 6,33% de H en masa con una masa molar de aproximadamente 240 g / mol. Determinar la fórmula molecular del tinte.
3.3 Molaridad
- Explique qué cambia y qué permanece igual cuando se diluyen 1,00 L de una solución de NaCl a 1,80 L.
- ¿Qué información se necesita para calcular la molaridad de una solución de ácido sulfúrico?
- Una muestra de 200 ml y una muestra de 400 ml de una solución de sal tienen la misma molaridad. ¿De qué manera son idénticas las dos muestras? ¿En qué se diferencian estas dos muestras?
- Determine la molaridad para cada una de las siguientes soluciones:
- 0.444 mol de CoCl2 en 0.654 L de solución
- 98.0 g de ácido fosfórico, H3PO4, en 1.00 L de solución
- 0,2074 g de hidróxido de calcio, Ca(OH)2, en 40,00 ml de solución
- 10.5 kg de Na2SO4·10H2O en 18.60 L de solución
- 7.0 × 10−3 mol de I2 en 100.0 mL de solución
- 1.8 × 104 mg de HCl en 0.075 L de solución
- Determine la molaridad de cada una de las siguientes soluciones:
- 1.457 mol KCl en 1.500 L de solución
- 0.515 g de H2SO4 en 1.00 L de solución
- 20.54 g de Al(NO3)3 en 1575 ml de solución
- 2.76 kg de CuSO4·5H2O en 1.45 L de solución
- 0,005653 mol de Br2 en 10,00 ml de solución
- 0,000889 g de glicina, C2H5NO2, en 1.05 mL de solución
- Considere esta pregunta: ¿Cuál es la masa del soluto en 0.500 L de 0.30 M de glucosa, C6H12O6, usada para inyección intravenosa?
- Resuma los pasos necesarios para responder la pregunta.
- Responda la pregunta.
- Considere esta pregunta: ¿Cuál es la masa de soluto en 200.0 L de una solución de 1.556 M de KBr?
- Resuma los pasos necesarios para responder la pregunta.
- Responda la pregunta.
- Calcule el número de moles y la masa del soluto en cada una de las siguientes soluciones:
- 2.00 L de 18.5 M H2SO4, ácido sulfúrico concentrado
- 100.0 ml de 3.8 × 10−5 M NaCN, la concentración letal mínima de cianuro de sodio en el suero sanguíneo
- 5,50 L de 13,3 M H2CO, el formaldehído usado para "arreglar" muestras de tejido
- 325 ml de 1,8 × 10−6 M FeSO4, la concentración mínima de sulfato de hierro detectable por el sabor en el agua potable
- Calcule el número de moles y la masa del soluto en cada una de las siguientes soluciones:
- 325 ml de 8.23 × 10−5 M KI, una fuente de yodo en la dieta
- 75.0 ml de 2.2 × 10−5 M H2SO4, una muestra de lluvia ácida
- 0.2500 L de 0.1135 M K2CrO4, un reactivo analítico utilizado en ensayos de hierro
- 10.5 L de 3.716 M (NH4)2SO4, un fertilizante líquido
- Considere esta pregunta: ¿Cuál es la molaridad de KMnO4 en una solución de 0.0908 g de KMnO4 en 0.500 L de solución?
- Resuma los pasos necesarios para responder la pregunta.
- Responda la pregunta.
- Considere esta pregunta: ¿Cuál es la molaridad del HCl si 35.23 ml de una solución de HCl contienen 0.3366 g de HCl?
- Resuma los pasos necesarios para responder la pregunta.
- Responda la pregunta.
- Calcule la molaridad de cada una de las siguientes soluciones:
- 0.195 g de colesterol, C27H46O, en 0.100 L de suero, la concentración promedio de colesterol en suero humano
- 4.25 g de NH3 en 0.500 L de solución, la concentración de NH3 en amoníaco doméstico
- 1,49 kg de alcohol isopropílico, C3H7OH, en 2,50 l de solución, la concentración de alcohol isopropílico en alcohol de frotar
- 0.029 g de I2 en 0.100 L de solución, la solubilidad de I2 en agua a 20 °C
- Calcule la molaridad de cada una de las siguientes soluciones:
- 293 g de HCl en 666 ml de solución, una solución de HCl concentrada
- 2.026 g de FeCl3 en 0.1250 L de una solución utilizada como desconocida en los laboratorios de química general
- 0,001 mg Cd2+ en 0,100 L, la concentración máxima permitida de cadmio en el agua potable
- 0.0079 g C7H5SNO3 en una onza (29.6 ml), la concentración de sacarina en un refresco de dieta.
- Hay alrededor de 1.0 g de calcio, como Ca2+, en 1.0 L de leche. ¿Cuál es la molaridad del Ca2+ en la leche?
- ¿Qué volumen de una solución de Fe (NO3)3 1.00 M se puede diluir para preparar 1.00 L de una solución con una concentración de 0.250 M?
- Si se diluyen 0.1718 L de una solución de C3H7OH de 0.3556 M a una concentración de 0.1222 M, ¿cuál es el volumen de la solución resultante?
- Si se diluyen 4.12 L de una solución de 0.850 M H3PO4 a un volumen de 10.00 L, ¿cuál es la concentración de la solución resultante?
- ¿Qué volumen de una solución de C12H22O11 0.33 M se puede diluir para preparar 25 ml de una solución con una concentración de 0.025 M?
- ¿Cuál es la concentración de la solución de NaCl que se obtiene cuando se deja evaporar 0,150 L de una solución de 0.556 M hasta que el volumen se reduce a 0.105 L?
- ¿Cuál es la molaridad de la solución diluida cuando cada una de las siguientes soluciones se diluye al volumen final dado?
- Se diluyen 1.00 L de una solución de Fe(NO3)3 0.250 M hasta un volumen final de 2.00 L
- Se diluyen 0.5000 L de una solución 0.1222 M de C3H7OH hasta un volumen final de 1.250 L
- Se diluyen 2,35 l de una solución 0,350 M de H3PO4 hasta un volumen final de 4,00 l.
- 22.50 mL de una solución 0.025 M de C12H22O11 se diluye a 100.0 mL
- ¿Cuál es la concentración final de la solución producida cuando se deja evaporar 225.5 ml de una solución de Na2CO3 0.09988 M hasta que el volumen de la solución se reduce a 45.00 ml?
- Se compró una botella de 2.00 L de una solución de HCl concentrado para el laboratorio de química general. La solución contenía 868,8 g de HCl. ¿Cuál es la molaridad de la solución?
- Un experimento en un laboratorio de química general requiere una solución de HCl 2.00 M. ¿Cuántos ml de HCl 11.9 M se necesitarían para fabricar 250 ml de HCl 2.00 M?
- ¿Qué volumen de una solución de K2SO4 0.20 M contiene 57 g de K2SO4?
- La Agencia de Protección Ambiental de los Estados Unidos (EPA, por sus siglas en inglés) establece límites en las cantidades de sustancias tóxicas que pueden descargarse en el sistema de alcantarillado. Se han establecido límites para una variedad de sustancias, incluido el cromo hexavalente, que se limita a 0,50 mg / L. Si una industria está descargando cromo hexavalente como dicromato de potasio (K2Cr2O7), ¿cuál es la molaridad máxima permisible de esa sustancia?
.
3.4 Otras Unidades para Concentraciones de Solución
- Considere esta pregunta: ¿Qué masa de una solución concentrada de ácido nítrico (68.0% de HNO3 en masa) se necesita para preparar 400.0 g de una solución de 10.0% de HNO3 en masa?
- Resuma los pasos necesarios para responder la pregunta.
- Responda la pregunta.
- ¿Qué masa de una solución de NaOH al 4,00% en masa contiene 15,0 g de NaOH?
- ¿Qué masa de NaOH sólido (97.0% de NaOH en masa) se requiere para preparar 1.00 L de una solución de 10.0% de NaOH en masa? La densidad de la solución al 10.0% es de 1.109 g / mL.
- ¿Qué masa de HCl está contenida en 45.0 ml de una solución acuosa de HCl que tiene una densidad de 1.19 g cm-3 y contiene 37.21% de HCl en masa?
- La dureza del agua (recuento de dureza) generalmente se expresa en partes por millón (en masa) de CaCO3, que es equivalente a miligramos de CaCO3 por litro de agua. ¿Cuál es la concentración molar de iones Ca2 + en una muestra de agua con un recuento de dureza de 175 mg de CaCO3 / L?
- Se sospechaba que el nivel de mercurio en una corriente estaba por encima del mínimo considerado seguro (1 parte por billón en peso). Un análisis indicó que la concentración era de 0,68 partes por billón. Suponga una densidad de 1,0 g / ml y calcule la molaridad del mercurio en la corriente.
- En Canadá y el Reino Unido, los dispositivos que miden los niveles de glucosa en la sangre proporcionan una lectura en milimoles por litro. Si se observa una medición de 5.3 mM, ¿cuál es la concentración de glucosa (C6H12O6) en mg / dL?
- Un spray para la garganta es 1.40% en masa de fenol, C6H5OH, en agua. Si la solución tiene una densidad de 0.9956 g / ml, calcule la molaridad de la solución.
- El yoduro de cobre (I) (CuI) se agrega a menudo a la sal de mesa como una fuente dietética de yodo. ¿Cuántos moles de CuI están contenidos en 1.00 lb (454 g) de sal de mesa que contiene 0.0100% de CuI en masa?
- Un jarabe para la tos contiene 5.0% de alcohol etílico, C2H5OH, en masa. Si la densidad de la solución es 0.9928 g / ml, determine la molaridad del alcohol en el jarabe para la tos.
- D5W es una solución usada como un fluido intravenoso. Es una solución de dextrosa (C6H12O6) en masa al 5.0% en agua. Si la densidad de D5W es 1.029 g / ml, calcule la molaridad de la dextrosa en la solución.
- Encuentre la molaridad de una solución acuosa al 40,0% en masa de ácido sulfúrico, H2SO4, para la cual la densidad es de 1.3057 g / ml.