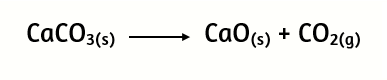
1. Representa cada una de las siguientes afirmaciones mediante una ecuación química balanceada:
a) El monóxido de carbono reacciona con el oxígeno gaseoso para formar dióxido de carbono gaseoso.
b) El dióxido de carbono reacciona con agua para dar ácido carbónico.
c) El ácido carbónico reacciona con el carbonato de calcio en disolución acuosa y forma hidrógeno carbonato de calcio.
d) El carbonato de calcio sólido se obtiene cuando reaccionan, en disolución acuosa, hidrógeno carbonato de calcio e hidróxido de calcio.
e) Cuando el hidrógeno carbonato de calcio acuoso reacciona con una disolución acuosa de hidróxido de sodio se obtiene carbonato de calcio sólido y carbonato de sodio, soluble en agua.
2. Indica el número de oxidación de los elementos que componen los compuestos de las reacciones anteriores.
3. A partir de la descomposición de la piedra caliza CaCO3

Calcula:
a) ¿Cuántos gramos de CaCO3 serán necesarios para obtener 1,5 moles de óxido de calcio?
b) ¿Cuántos moles de dióxido de carbono se desprenden en esta reacción?
4) ¿Cuántos gramos de Fe se pueden oxidar a óxido férrico con un mol de moléculas de oxígeno?
5) El amoníaco se produce mediante la reacción entre el hidrógeno molecular y el nitrógeno molecular.
Calcula:
a) ¿Cuántos moles de moléculas de hidrógeno se necesitan para preparar 3 kg de amoníaco?
b) ¿Cuántos moles de amoníaco se producen por la reacción completa de 10 moles de nitrógeno?
c) ¿Cuántos moles de hidrógeno se necesitan para producir 47,6 g de amoníaco?
6) ¿Cuántos moles de oxígeno se necesitará para quemar 1,00 kg de pentano, C5H12(g), que posee un 12% de sustancias que no participan en la combustión?
7) Una determinada cantidad de FeCl3 ha sido oxidada completamente y todo el cloro se ha desprendido en forma de Cl2. Este cloro gaseoso se ha empleado para transformar Si en SiCl4. Se han producido 6,36 moles de SiCl4. ¿Cuántos gramos de FeCl3 fueron oxidados?
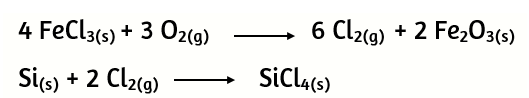
8) En una de las etapas del proceso industrial de obtención de titanio puro ocurre la siguiente reacción: el tetracloruro de titanio líquido se oxida dando dióxido de titanio sólido y gas cloro. Determine la pureza del tetracloruro de titanio, si al hacer reaccionar 4,0 toneladas del mismo, en exceso de oxígeno, se obtuvieron 1,4 toneladas de dióxido de titanio.
9. Cuando se colocó una cinta de magnesio de 20,0 g en un vaso de precipitado con una disolución acuosa de ácido clorhídrico, una vigorosa reacción produjo hidrógeno gaseoso, cloruro de magnesio y suficiente calor para que el vaso se sintiera caliente al tacto.
a) Escribe una ecuación balanceada que represente la reacción.
b) Indica cuántos moles de hidrógeno gaseoso se produjeron.
c) Calcula cuántos gramos de ácido clorhídrico se consumieron durante la reacción.
d) Calcula los gramos totales de reactivos y los gramos totales de productos.
10) Si en el laboratorio se hace reaccionar una chapa de hierro de 125 g con 2 moles de oxígeno gaseoso se obtiene:
a) 179 g de trióxido de dihierro
b) 209 g de trióxido de dihierro
c) 89,5 g de trióxido de dihierro
11. Si se queman 5,120 g de cinta de magnesio, ¿cuántos gramos de óxido de magnesio se forma en la combustión? Escribe y balancea la ecuación.
12. Si el vehículo de las misiones Apolo a la Luna consumió 4,0 toneladas de dimetil-hidracina (CH3)2NNH2, como combustible, ¿cuántas toneladas de oxidante N2O4 se requirieron para reacción con ella? Escribe y balancea la ecuación sabiendo que al reaccionar dimetil-hidracina con el oxidante N2O4 se obtienen como productos N2, CO2 y H2O.
13. Dada las siguientes reacciones:
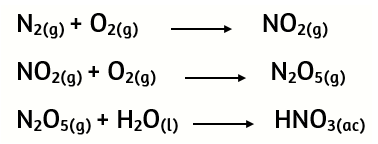
Balancea cada reacción y calcula la masa de N2 que debe reaccionar para obtener 180 g de HNO3.
14. El jugo gástrico contiene aproximadamente 3,0 g de HCl por litro. Si una persona produce unos 2,5 L de jugo gástrico diariamente, ¿cuántas tabletas antiácidas de 400 mg de Al(OH)3, se necesitan para neutralizar todo el HCl producido en un día?

15. Calcula los moles de dióxido de carbono obtenido cuando se queman 100 g de butano (C4H10). Escribe y balancea la ecuación correspondiente.
16. El ser humano exhala aproximadamente 0,350 g de CO2 por minuto. Suponiendo que todo el CO2 proviene de la reacción de la glucosa (C6H12O6) con O2:
a) Escribe y balancea la ecuación de la reacción.
b) ¿Cuántos moles de O2 y cuántos gramos de glucosa se consumen por minuto?
c) ¿Cuántos gramos de glucosa se consumen por día en la respiración?
17. Dadas las siguientes reacciones:

Calcula los moles de HCl (según la ecuación a) que deben reaccionar para obtener igual cantidad de cloro que la que resulta a partir de 5,00 g de NaCl (según la ecuación b).
18. El nitruro de mangesio Mg3N2 sólido reacciona con agua para producir hidróxido de magnesio acuoso y amoníaco gaseoso. ¿Cuántos gramos de amoníaco se puede obtener a partir de 5,00 g de nitruro de magnesio?
19. En la reacción entre el óxido de cromo (III) Cr2O3 sólido y el aluminio metálico, que produce cromo metálico y óxido de aluminio Al2O3 sólido, ¿cuál es la máxima cantidad de cromo metálico que puede prepararse si reaccionan 38,0 g de Cr2O3 con 9,00 g de aluminio? Escribe y balancea la ecuación.
a) 47,0 g
b) 26,0 g
c) 8,67 g
d) 200 g
e) 17,3 g
20. El magnesio metálico de los fuegos artificiales reacciona con el oxígeno del aire para producir un destello blanco brillante. El producto de esta reacción de combinación es óxido de magnesio, sólido. ¿Cuántos gramos de óxido de magnesio se forman cuando reaccionan 0,50 moles de magnesio con 0,25 moles de oxígeno gaseoso? Escribe y balancea la ecuación.
a) 202 g
b) 20,2 g
c) 2 g
d) 22 g
e) Ninguno
21.Determina los gramos de SF4 que se obtienen cuando 400 g de SCl2 reaccionan con 2,00 g de NaF, de acuerdo con la siguiente ecuación de reacción:
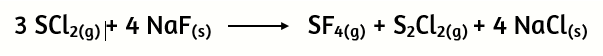
a) 13 g
b) 3 g
c) 1 g
d) 133 g
e) Ninguno
22. El carburo de silicio SiC, también conocido como carborundo, es un abrasivo industrial muy importante que se prepara mediante la reacción a altas temperaturas de SiO2 con carbono.
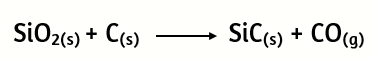
a) Verifica si la ecuación está correctamente balanceada
b) Determina cuál será el reactivo limitante cuando reaccionan 5 moles de SiO2 y 6 moles de carbono.
c) ¿Cuántos gramos de carburo de silicio (SiC) se pueden formar?
d) ¿Cuántos gramos del reactivo en exceso quedan al terminar la reacción?
23. En el siguiente caso de combustión del etileno:
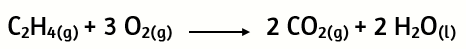
¿Cuántos gramos de CO2 se formarán al encender una mezcla que contiene 1,93 g de etileno y 5,92 g de oxígeno?
24. En la reacción de producción del ácido nítrico a partir del dióxido de nitrógeno se utilizan 2 moles de H2O y 5 moles de NO2.

Calcula: a) ¿Cuál es el reactivo limitante?
b) ¿Cuántos gramos de ácido nítrico se obtendrán?
25. Dada la siguiente ecuación química:
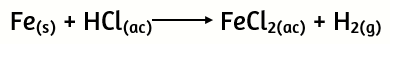
a) Balancéala adecuadamente
b) Calcula:
i) ¿Cuántos gramos de Fe se consumieron si se obtuvieron 0,45 moles de H2?
ii) ¿Cuántos moles de HCl reaccionan con 7 gramos de Fe?
iii) ¿Cuántos gramos de HCl se requieren para obtener 0.25 moles de sal?
iv) Si a 6 gramos de Fe se le añaden 0,4 moles de HCl:
I) ¿Cuántos gramos de sal se forman?
II) ¿Cuántos gramos del reactivo en defecto deben añadirse para que reaccione totalmente el reactivo que inicialmente se hallaba en exceso?
26. El H3PO4(ac) reacciona con Mg(OH)2(s) produciendo Mg(H2PO4)2(ac). Escribe la ecuación química y calcula:
a) ¿Cuántos gramos de sal se obtendrán por reacción entre 1,5 moles del ácido con 11 gramos del hidróxido?
b) ¿Cuántos moles y cuántos gramos de cada una de las especies permanecen una vez finalizada la reacción?
c) ¿Cuántos gramos del reactivo en defecto hay que agregar para que reaccione completamente el reactivo que originalmente estaba en exceso?
27. El mercurio reacciona con el bromo para producir bromuro mercúrico. Escribe la ecuación química balanceada y calcula:
Cuando 250 g de bromo reaccionan con 250 g de mercurio:
a) ¿Cuál de las sustancias está en exceso?
b) ¿Cuántos g de bromuro mercúrico se producen?
c) ¿Qué masa de la sustancia en exceso quedó sin reaccionar?
d) ¿Cómo respondería a la pregunta a) si en lugar de hacer reaccionar masas iguales de los reactivos, se hacen reaccionar un numero idéntico de moles de cada uno?
28. La descomposición térmica de nitrato de potasio generó 5,63 moles de oxígeno de acuerdo a la reacción:
nitrato de potasio sólido produce nitrito de potasio sólido + oxígeno
Calcula:
a) ¿Cuántos gramos del reactivo se han usado?
b) ¿Qué masa y qué cantidad de nitrito de potasio (moles) se han producido?
29.Considera la reacción entre níquel metálico y disolución de ácido sulfúrico para dar sulfato de níquel disuelto e hidrógeno.
a) Escribe y balancea la reacción correspondiente.
b) Calcula la cantidad necesaria de ácido sulfúrico para que reaccione totalmente con 58 g de níquel.
c) ¿Cuál es la masa de hidrógeno producida?
d) Calcula la masa de la sal formada.
30. El cloruro de aluminio, AlCl3, se utiliza como catalizador en diversas reacciones industriales y se prepara a partir de cloruro de hidrógeno y viruta de aluminio metálico. Considerando que un balón de reacción contiene 0,15 moles de de Al y 0,35 moles de HCl, calcula cuántos moles de AlCl3 se pueden preparar a partir de ésta mezcla.
31. Dada la combustión del metano, si se colocan 2000 g de CH4 de pureza 90% y 230 moles de O2 calcula:
a) ¿cuál es el reactivo limitante?
b) ¿cuántos gramos, moles y moléculas de H2O se forman?
c) ¿cuántos moles de CO2 se producen?
32. Se tratan 200 g de una muestra de Zn de 90% de pureza con un exceso de disolución de H2SO4. Como producto de la reacción se forman ZnSO4 y H2, este último en estado gaseoso. ¿Cuántos moles de H2 se obtendrán si el rendimiento del proceso es del 85%?
33.Responde Verdadero o Falso justificando en cada caso:
a) 4 moles de moléculas de cloro con exceso de hidrógeno, producen 2 moles de moléculas de cloruro de hidrógeno.
b) En la obtención de amoníaco, si se colocan 55 g de hidrógeno gaseoso en un recipiente junto con 55 g de nitrógeno gaseoso, el reactivo en exceso es el hidrógeno.
c) Si con 32 g de azufre obtengo medio mol de dióxido de azufre, el rendimiento fue del 100%.
d) Si una reacción tiene un rendimiento del 80%, por cada 50 moles teóricos de producto se obtienen solo 40 moles.
e) Si el reactivo B tiene una pureza del 60%, 40 de cada 100 g son realmente de B puro.
34.La urea, (NH2)2CO se utiliza como fertilizante porque puede reaccionar con agua para liberar amoniaco, que proporciona nitrógeno a las plantas y dióxido de carbono. Determina:
a) El número de átomos de N, C, O e H en 1,68 x10 4 g de urea.
b) ¿Qué sustancia se consume por completo cuando se combinan 0,45 kg de urea, que tiene una pureza del 93% con 150 mL de agua?
c) ¿Qué masa máxima de amoníaco se puede preparar con esas cantidades?
d) Si el rendimiento esperado es del 88%, ¿cuántos moles de amoníaco se formarán?
35. Hallar la pureza de una muestra de FeS sabiendo que al tratar 122 g de la misma con ácido clorhídrico se desprenden 1 mol de H2S. (El otro producto de la reacción es el cloruro ferroso).
36. Cuando se calientan carbonatos se forma dióxido de carbono. Este proceso se utiliza industrialmente para obtener cal viva (CaO) a partir de caliza (CaCO3). Calcula la masa de dióxido de carbono producida al descomponerse 12 g de carbonato de calcio de 90% de pureza. Además calcula los moles del gas producido.
¿Cuál será la pureza de una muestra de sulfuro de potasio si con 240 g del mismo se pueden obtener 0,27 moles de ácido sulfhídrico?
sulfuro de potasio sólido + disolución de ácido clorhídrico, produce, cloruro de potasio disuelto + ácido sulfhídrico acuoso