| Page 1 |

Vol. 28
|
Nº 54
|
mayo de 2017
ISSN
1851-1716


HUMANIDADES Y CIENCIAS SOCIALES

invest igación
Entre oportunidad y riesgo. Regulación, expectativas
y políticas ct i para células madre en Argentina
Bortz, Gabriela*; Vasen, Federico**; Rosemann, Achim***
Resumen
En Argentina las células madre son ident
por cientí
y funcionarios de

Ciencia, Tecnología e Innovación (ct i) como una prioridad estratégica. Esta
nición

de políticas se ve traducida en el creciente esfuerzo estatal para promover la cons-


trucción de capacidades en esta tecnología a través de programas, nanciamiento y

jo explora la forma en

que se han
localmente los procesos de desarrollo de terapias con células

madre. Se analiza la tensión entre la construcción de capacidades, expectativas de

ingreso económico, esperanzas por sus potenciales aplicaciones terapéuticas y los

riesgos que esta tecnología trae aparejados. Se muestra cómo los intentos de generar

una normativa especí ca, impulsada por actores ligados a las políticas de ct i, busca

mediar entre el riesgo y las expectativas moldeando la investigación y los productos


desarrollados localmente para el posicionamiento nacional como referente internacional

en esta tecnología emergente.

Palabras clave: células madre; medicina regenerativa; políticas de ct i; regulación;



bioeconomía





Este trabajo se enmarca en una línea de investigaciones sobre la construcción de tecnologías estraté-


gicas en Argentina desarrollada desde el Área de Estudios Sociales de la Tecnología y la Innovación


del Instituto de Estudios sobre la Ciencia y la Tecnología de la Universidad Nacional de Quilmes



(iesct -unq) y en una línea de trabajo de cooperación internacional con la Universidad de Warwick


sobre transformaciones en la bioeconomía y regulación en tecnologías emergentes. Presentado el



21/08/2016 y admitido el 06/02/2017.


Aut or es: *Instituto de Estudios sobre la Ciencia y la Tecnología, Universidad Nacional de Quilmes



(iesct -unq), Argentina, Consejo Nacional de Investigaciones Cientí as y Técnicas (conicet ), Argen-



tina. ** Instituto de Estudios sobre la Ciencia y la Tecnología, Universidad Nacional de Quilmes (iesct -


unq), Argentina, Instituto de Investigaciones Sociales, Universidad Nacional Autónoma de México,


México. ***Centre for Education Studies, Faculty of Social Sciences, University of Warwick, Reino Unido.


Cont act o: gabybortz@gmail.com






































Universidad Nacional de Entre Ríos | Eva Perón 24; 3260 FIB Concepción del Uruguay, Entre Ríos, Argentina | (38-74)
38
| Page 2 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Between opportunity and risk. Regulation, expectations and innovation policies
for stem cells in Argentina
Abstract
In Argentina, scientists and Science, Technology and Innovation (st i) public
cials


identify stem cells as a strategic priority.

state
to promote capacity building in this technology through programs, funding

and debates to generate a
regulatory framework. This work aims to explore

how state support for research and development (R&D) in stem cells is locally built.


With this purpose, we explore the tension between investment in capacity building and



the construction of expectations on income revenues, hopes for potential therapeutic


applications, and potential risks. We will show how the attempts to generate a spec c



regulation, driven by actors linked to st i policy, seek to mediate between risk and ex-


pectations shaping research and locally developed products for positioning the country


as an international player in this emerging technology.


Keywords: stem cells, regenerative medicine, st i policies, regulation, bioeconomy.

Entre oportunidade e risco. Regulamento, expectativas e políticas ct i



para células-tronco na Argentina


Resumo


Na Argentina as células-tronco s



Tecnologia e Inovação (ct i) como uma prioridade estratégica. Esta
de políticas


se traduz no crescente esforço estadual para promover a construção de capacidades



nesta tecnologia através de programas, nanciamento e debates para gerar um marco


regulatório especí co. Este trabalho explora como estão c
localmente os


processos de desenvolvimento de terapias com células-tronco. Analisa-se a tensão



entre a construção de capacidades, as expectativas de renda, as esperanças por suas

potenciais aplicações terapêuticas e os riscos que esta tecnologia traz consigo. Mos-


tra-se como as tentativas de gerar uma regulamentação especí a, impulsionada por


atores ligados às políticas de ct i, pretendem mediar entre o risco e as expectativas

moldando a pesquisa e os produtos localmente desenvolvidos para o posicionamento


nacional como referência internacional nesta tecnologia emergente.



Palavras-chave: células-mãe; medicina regenerativa; políticas de ct i; regulamento;

bioeconomia











































































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
39
| Page 3 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
I. Introducción
El
del siglo xx y las primeras décadas del siglo xxi han sido el escenario

de emergencia de nuevas transformaciones y posibilidades en el campo de la

salud y, en particular, de la biomedicina: secuenciación del genoma humano,


ingeniería genética, terapias génicas, tecnologías reproductivas como el diag-
nóstico genético preimplantacional (pgd), clonación, nuevas capacidades en
diagnóstico de enfermedades genéticas, en trasplante de órganos e, incluso,
aún más reciente, la posibilidad de bio-impresión de tejidos humanos.
Estas transformaciones han suscitado agitados debates entre políticos,
universidades,
empresas, la industria farmacéutica, inversores


privados, bioeticistas y, de manera creciente, grupos de pacientes organi-


zados: generan esperanzas de curas novedosas y efectivas para toda clase


de enfermedades y dolencias y, a la vez, inquietud sobre la efectividad y

seguridad de los tratamientos y los riesgos asociados; despiertan expecta-

tivas por nuevos desarrollos patentables que permitan impulsar lucrativas

bioeconomías y, a la vez, recelos por un posible direccionamiento de los

senderos cientí co-tecnológicos hacia terrenos en la «frontera del conoci-

miento», que promuevan la acumulación de capital simbólico de cientí

y nuevas terapias para pocos, en detrimento de soluciones a problemas de

salud pública de la mayoría de la población (Rose, 2012).

En el marco de estos cambios en las tecnologías biomédicas, en los

últimos 20 años, las terapias basadas en células madre han adquirido un

papel prioritario en las agendas de investigación y desarrollo (I+D) a nivel
mundial. Actualmente, a la vez que Estados Unidos, la Unión Europea y
Japón se encuentran desarrollando importantes programas de I+D y marcos
regulatorios especí os en la temática, países como India, China, Brasil y

Argentina también están implementando programas para la construcción

de capacidades en medicina regenerativa y avanzando en la construcción
de normativas especí cas (McMahon y Thorsteinsdóttir, 2013; Rosemann et

al., 2016).
Las células madre, células troncales o stem cells (cm) son células no es-
pecializadas que, al dividirse, son capaces de generar una célula igual a sí
misma y una célula precursora (más diferenciada) de una familia celular. La
capacidad de estas células de diferenciarse en otras y de proliferar en más
células madre idénticas a la primera1, abre un abanico de promesas para la
investigación y la práctica clínica. Los cientí
esperan que, al aprender

a controlar procesos de cultivo, clonación, diferenciación y reprogramación

celular, sea posible producir células y tejidos sanos que puedan utilizarse



Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
40
| Page 4 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
para reparar el daño funcional o estructural de un tejido u órgano o, incluso,
suplantarlo. La medicina regenerativa comprende, justamente, aquellos tra-
tamientos en los cuales las células troncales son inducidas a diferenciarse
en las células
requeridas para reparar estos daños (Argibay,


2005). Si bien el uso de células madre para el tratamiento de enfermedades


hematológicas, tomando como fuente la médula ósea, la sangre periférica


y el cordón umbilical, son prácticas ya establecidas en medicina, el desafío

actual es utilizar las células madre provenientes de estos y otros tejidos para

lograr la diferenciación in vivo o in vitro en células de otra estirpe (Argibay,


2005; Stephens et al., 2011).
Las expectativas construidas por cientí cos, funcionarios públicos y me-

dios de comunicación a nivel internacional sobre el desarrollo de células
madre se anclan en sus potenciales «aplicaciones revolucionarias»: según
lulas madre



puede llevar a «saltos tecnológicos» en el tratamiento de una pluralidad de



patologías, como el cáncer, enfermedades neurodegenerativas (Parkinson,


Alzheimer), fallas cardíacas, diabetes, etc. (Mimeault et al., 2007; Singer,


2008; Mattis y Svendsen, 2011; Hardie, 2011; conicet, 2012).



En este escenario, la Argentina no ha sido la excepción. En particular,


en nuestro país, es posible
tres tendencias que se encuentran


en tensión.


Por un lado, un esfuerzo creciente a nivel estatal para promover la



inversión y construcción de capacidades en esta tecnología (a través de




políticas públicas, líneas de
o y debates para generar un mar-


co regulatorio
Estos esfuerzos han tenido como correlato un


crecimiento de la I+D en laboratorios públicos (y algunos privados) a nivel


básico, pre-clínico y clínico (aunque este último de manera más incipiente)


con principal foco de aplicación en cardiología, neurociencias, oncología,


enfermedades metabólicas, dermatología y traumatología, entre otras. En el


discurso estatal, los desarrollos en células madre y, de modo más amplio,

la medicina regenerativa son consideradas estratégicas para el desarrollo

nacional, al ser pensadas como una oportunidad de posicionamiento en

biotecnologías de última generación (mincyt , 2008; conicet, 2012; mincyt ,


2012; Fressoli y Bortz, 2012).



En segundo lugar, la construcción de expectativas por el desarrollo y


aplicación terapéutica de esta tecnología en la opinión pública. Esto se ma-

a, por un lado, desde distintas formas de activismo de pacientes, con

la esperanza de acelerar los procesos mediante los cuales se desarrollan

curas y terapias. Pero, por otro lado, desde la publicidad tanto de clínicas










































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
41
| Page 5 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
que ofrecen lucrativos tratamientos experimentales como de biobancos que
ofrecen servicios de criopreservación de células madre de placenta y cordón
umbilical para uso autólogo2. Estos nuevos actores están orientados a la ge-
neración de renta a partir de bienes y servicios basados en el procesamiento
de material biológico (Waldby, 2002; Rose, 2012; Birch y T
2012).


En tercer lugar, un proceso de construcción del riesgo de estos tratamien-


tos y de intentos de regulación de estas tecnologías emergentes. En este

sentido, cientí cos, policy makers, bioeticistas y organizaciones de pacientes

han comenzado a alertar frente a los riesgos de algunos tratamientos que

se publicitan y ofrecen a los pacientes, en muchos casos sin el respaldo
de evidencia clínica sistemática y con
de lucro. La proliferación de la

oferta de estos tratamientos experimentales ha provocado controversias

sobre los límites éticos, los riesgos y estándares cientí os bajo los cuales

las células madre pueden utilizarse en tratamientos en humanos (Arzuaga,

2013; McMahon, 2014). Esta situación tiene lugar en un escenario en el cual

los marcos regulatorios existentes a nivel nacional e internacional para el

testeo clínico y aprobación de mercado de medicamentos no se adecúan a
las características particulares de los tratamientos con células madre (Arzua-
ga, 2013; Harmon y Kale, 2015). Estos procedimientos desafían el paradigma
establecido globalmente de regulación farmacéutica «basada en la eviden-
cia», en particular, ensayos clínicos randomizados multifase (Rosemann,
2014), y bajo el cual se administra hoy la aprobación de los medicamentos
de síntesis química (Dämmrich, 2004; Dumit, 2012).
Este trabajo tiene como objetivo explorar la forma en que se ha
-

rado localmente los procesos de desarrollo de terapias con células madre.


Esto involucra analizar la tensión entre a) la construcción de capacidades en


células madre en Argentina y las estrategias de promoción estatal, bajo el


supuesto de que constituyen una «oportunidad» para desarrollo tecnológico
y desarrollo (bio)económico, b) la construcción de expectativas en los pa-
cientes y c) la conformación de un marco regulatorio que dé respuesta a las
crecientes alertas sobre los riesgos de esta nueva tecnología de la vida. Se
mostrará cómo las controversias sobre regulación en células madre tienen
lugar en la mediación entre estos tres elementos. A través del análisis de
estas tres dimensiones, nos preguntamos cuáles son las tendencias predo-
minantes en el país y en qué discursos y marcos conceptuales se inscriben.
La investigación se basa en un diseño cualitativo de análisis documental
(noticias, currículum vitae, proyectos de I+D, sitios web y comunicados ins-
titucionales, planes nacionales de Ciencia, Tecnología e Innovación, leyes,
resoluciones ministeriales, proyectos legislativos, etc.). Se han realizado ade-

Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
42
| Page 6 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
más 6 entrevistas en profundidad a cientí
, policy makers, reguladores

provenientes de distintas agencias nacionales y miembros de organizaciones

de pacientes.

A nivel teórico-metodológico, el trabajo parte de una extensa literatura so-

bre la capitalización de las ciencias de la vida. Ésta ha sido conceptualizada
en términos de «biovalor» (Waldby, 2002; Waldby y Mitchell, 2006; Rose,
2012)3, «bioeconomías» (Rose, 2012), «biocapital» (Rajan, 2006), para dar
cuenta del modo en que los «fragmentos vitales» se transforman en mercan-
cía. En este trabajo entendemos la generación de valor a partir de material
biológico desde la propuesta crítica de Birch y Ty
(2012): a) lo que crea

valor no son las cualidades latentes del material biológico en sí, sino el tra-


formar estos

fragmentos en bienes intercambiables (Birch y Ty
2012:308); b) el valor


se realiza a través del intercambio de mercado, que habilita la extracción de



renta; c) en la generación de valor a partir de material biológico resulta más



conveniente hablar de «activos» que de «mercancías», puesto que mientras



que la segunda es sólo un objeto producido para el intercambio, el primero



es un recurso (tangible o intangible) que tiene valor como propiedad y, a la


vez, puede usarse para producir valor.



Complementariamente, se utilizará el concepto de «imaginarios so-


cio-técnicos» (Jas
y Kim, 2009) para abordar la intersección entre la


construcción social de expectativas sobre las tecnologías (desde cientí



pacientes, empresas) y el rol del Estado en la
de la orientación


de la inversión pública en Ciencia, Tecnología e Innovación (ct i). Los ima-


ginarios socio-técnicos son
como «formas de vida y orden social


colectivamente imaginados que se
an en el diseño y concreción de



proyectos
nacionales
y Kim,


2009: 120). En la medida que los imaginarios describen futuros alcanzables,




proyectando visiones sobre qué es bueno, deseable y vale la pena empren-


der por parte del Estado, permiten enlazar la construcción de expectativas

y riesgos con ejercicios efectivos de la capacidad estatal de
el

desarrollo tecnológico, en la elección de prioridades y asignación de gasto

público.


El trabajo se estructura de la siguiente manera: en el primer apartado

aborda las células madre como objeto de la bioeconomía y la capacidad

de esta tecnología de transformarse en valor. Esto se analiza, por un lado,

desde el ámbito estatal, en las formas y supuestos bajo los cuales se cons-



truyen capacidades en esta nueva tecnología en el país y, por el otro, desde

el lugar de los privados en la oferta de bienes y servicios basados en ésta.

























































































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
43
| Page 7 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
El segundo apartado focaliza en la construcción de nuevas subjetividades
y expectativas por parte de los usuarios (presentes y/o potenciales). El ter-
cero, aborda la problemática actual de la normativa sobre células madre en
Argentina como forma de regular entre la expectativa y el riesgo.
El texto argumenta cómo el imaginario socio-técnico promovido desde
el Estado para direccionar la trayectoria de desarrollo tecnológico en esta
área responde a una estrategia de posicionamiento cientí
internacional.

En este proceso, la construcción de una normativa especí a para células

madre, impulsada por actores ligados a las políticas de Ciencia, Tecnología

e Innovación, busca mediar entre el riesgo y la expectativa adecuando la in-

vestigación y los productos desarrollados localmente para el posicionamiento

del país como referente en esta tecnología emergente a nivel internacional.
II. Las células madre como objeto de la bioeconomía
II.1. La economía de las células madre a nivel global
Actualmente diversos actores
políticos, sanitarios, empresarios


e inversores sostienen que las células madre tienen el potencial de trans-


formar la asistencia sanitaria asegurando tratamientos costo-efectivos para


enfermedades con escasas alternativas terapéuticas al presente. Se aduce

que esto es particularmente
en un escenario de envejecimiento

poblacional y de incremento de pacientes con enfermedades neurológicas y

crónicas, con la expectativa de que estos tratamientos regenerativos permi-

tan evitar las drogas tradicionales, dispositivos y cirugías para estos grupos

de pacientes.


Distintos análisis del mercado de células madre global calcularon para


2013 que la generación de ingresos fue de entre 37.880 (Grand View Re-

search, 2015) y 40.010 millones de dólares (Frost y Sullivan, 2014) para

células madre humanas adultas y embrionarias, estimando tasas de creci-



miento anual compuestas de entre el 20 y 24
% (en base a la segunda, la


cifra de 2013 se triplicaría en 2018 a 117.660 millones de dólares). Además,

mientras que se ident
ó a Norteamérica como el líder del mercado, con

más de la mitad de la participación del mercado mundial, se espera que la

región Asia-Pací co registre la tasa de crecimiento anual más alta durante

el período. Para dicho mercado, valuado en 5.600 millones de dólares en

el año 2013, se prevé un aumento para el año 2018 a 18.710 millones. Estos
estudios muestran el signi
vo incremento de
anciamiento de I+D para

investigación en células madre y de inversión privada (tanto de empresas



como de capitales de riesgo) en los últimos 5 a 10 años.




Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
44
| Page 8 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Las células madre aparecen como una nueva forma de generación de
ingreso en el marco de la bioeconomía. La vitalidad se descompone en una
serie de elementos biológicos (tejidos y células) que pueden ser separables
del cuerpo, aislados, delimitados, congelados, almacenados, acumulados,
negociados e intercambiados en el mercado. Tejidos, proteínas, células son
considerados elementos o unidades manipulables y transferibles, con el

de generar valor a partir de los procesos biológicos con nes de crecimiento

económico (Franklin, 2000; Rose, 2012; ocde, 2006).

En este escenario, la generación de capacidades locales en células ma-
dre se presenta como una alternativa atractiva para países en desarrollo,
ante la posibilidad de participar de este mercado emergente. Esta es propi-
ciada tanto en la literatura académica como en las declaraciones de policy
makers, que fomentan el desarrollo de la tecnología de células madre y la
medicina regenerativa por encontrarse en su etapa de construcción inicial
(Greenwood et al., 2006; mincyt , 2008; McMahon y Thorsteinsdóttir, 2013;
Palma et al., 2015).
Greenwood et al. (2006), por ejemplo, sostienen que los países en vías de
desarrollo «podrían
potencialmente de los avances en medicina


regenerativa para enfrentar las epidemias de enfermedades no transmisibles


y otras acuciantes necesidades sanitarias». Estos autores –entre otros– con-


sideran que la innovación local en estos campos puede llevar a tratamientos


más accesibles para la población, constituir una base tecnológica y cognitiva


disponible para la solución de necesidades domésticas y contribuir con la

salud y el desarrollo económico. En este sentido, McMahon y Thorsteinsdóttir
(2013), en su análisis comparativo del campo de la medicina regenerativa
en India, Brasil y China, muestran cómo países como India, Brasil y China
han comenzado estrategias nacionales de desarrollo acelerado en medicina
regenerativa.
II.2. La economía de las células madre en Argentina
II.2.1. La promoción desde el Estado
En Argentina el Ministerio de Ciencia, Tecnología e Innovación Productiva
(mincyt ) considera la tecnología basada en células madre como uno de los
principales núcleos socio-productivos estratégicos (nspe) dentro del área de
salud (mincyt , 2012). Desde los años 2006 y 2007 es posible ver la construc-
ción de esta tecnología como una «prioridad estatal en términos de investi-
gación y desarrollo» (Palma et al., 2015) a partir de un proceso creciente de
asignación de fondos, programas, articulación de redes y generación de las
primeras tentativas hacia su regulación.
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
45
| Page 9 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Uno de los principales focos de acción estatal en estos años ha sido la
inversión en la construcción de capacidades de I+D a través de un conjunto
de instrumentos de promoción y
o especí os:
-

to de un consorcio de investigación sobre células madre (cicema, 2008),

compuesto por 11 instituciones incluyendo grupos de investigación básica,


traslacional y clínica, una unidad de vinculación tecnológica y fundaciones


y empresas privadas4;
de la Plataforma de Células Madre


Reprogramadas Humanas (pl acema, 2011), orientada al desarrollo disciplinar

de la reprogramación y diferenciación celular con vistas a su transferencia


clínica y al sector productivo5; establecimiento de un convenio de coopera-


ción binacional con Brasil (pr obit ec, 2009) para la formación de recursos


humanos y líneas de subsidios de I+D especí cos (2011) para investigación

básica, traslacional e investigación clínica.6


Estos esfuerzos han tenido como resultado un proceso de construcción


de capacidades endógenas en investigación. Las mismas se encuentran


concentradas especialmente en diez unidades de I+D, predominantemente

ubicadas en el Área Metropolitana de Buenos Aires, entre las cuales se


destacan la Fundación Instituto Leloir, f l eni, Hospital Italiano, Facultad de

Ciencias Exactas y Naturales - Universidad de Buenos Aires (f ceyn-uba),

Hospital de Pediatría samic Prof. Dr. J.P. Garrahan, la Fundación Favaloro y


la Universidad Austral. Los centros e institutos de investigación se presentan


–hasta el momento– como el principal locus de I+D en células madre, de


construcción de capacidades y formación de recursos humanos.

El apoyo público redundó en un crecimiento de 18 proyectos


en 2008 a 47 en el 2012 (Palma et al., 2015). Entre las principales líneas de

trabajo, se encuentran investigaciones sobre diferenciación y reprogramación

celular, mejoramiento de los medios de cultivo para la proliferación y conser-

vación de células madre, con foco de aplicación en las áreas de cardiología,

neurociencias (en especial, enfermedades neurodegenerativas), oncología,

dermatología y enfermedades metabólicas. Se ha trabajado sobre células


hematopoyéticas y neurales, en la reprogramación y diferenciación de célu-


las madre adultas y desarrollos en células pluripotenciales inducidas (ips).


En términos generales, la mayor parte se enmarcan en la investigación

básica y, en segundo término, en la investigación pre-clínica. Se registraron

cuatro protocolos de ensayos clínicos: el primero, realizado en 2005, para
tratamiento de la miocardiopatía chagásica por cardioingerto de células au-
tólogas; y luego, a partir de 2012, estudios sobre los efectos de las células
madre adultas (precursores hematopoyéticos) sobre el accidente cerebrovas-
cular (Fundación f l eni, en cooperación con Brasil);
acia de la donación






Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
46
| Page 10 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
autóloga para el tratamiento de lesiones del cartílago (laboratorio nacional
Craveri); capacidad de las células madre mesenquimales en regeneración
de la piel en los casos de pacientes quemados (Ministerio de Salud bonae-
rense, a través del cucaiba, y Hospital Municipal de Quemados de la Ciudad
de Buenos Aires). Estos son realizados por institutos de I+D, una empresa
privada, y con participación de hospitales (cacm-mincyt , s.f.; Roman, 2012).
En términos generales, los investigadores de los principales centros de
I+D mencionados se han constituido en importantes impulsores del apoyo
estatal al sector a través de una pluralidad de iniciativas institucionales,
regulatorias y de nanciamiento.

II.2.2. Células madre como ventana de oportunidad
Hemos visto cómo la inversión estatal en medicina regenerativa ha tenido
resultados positivos en términos de construcción de capacidades. ¿Pero qué
visiones alientan la promoción de las células madre como tecnología priorita-
ria? ¿De qué manera y para quiénes ésta se construye como deseable y un
objetivo a alcanzar?
Desde las agencias estatales de ct i, la tecnología basada en células
madre ha sido
ada como una «oportunidad»:


La estrategia del Ministerio en torno a la medicina regenerativa y las terapias


celulares es «actuar como un puente entre la investigación básica y la investi-

gación clínica, generando un plan estratégico de desarrollo e inversión en esta

temática». El [Ministro] Dr. Barañao remarcó que el trabajo en éste área es de

particular importancia para la Argentina e indicó que «la temática es nueva, por
lo que avizoramos que se trata de una gran oportunidad para el desarrollo de
esta rama de la ciencia en nuestro país». (mincyt , 2008)
El campo de las células madres es un área emergente a nivel internacional
en donde la Argentina, por su tradición en investigación y su especialización
orientada fuertemente a las ciencias biomédicas, puede desempeñar


un rol destacado (entrevista al exdirector de la anpcyt, en García, 2011).


La posibilidad de hacer una plataforma biotecnológica para producir células


a partir de células reprogramadas es una oportunidad de oro (entrevista a cien-

conicet, 2012)

Esto se refuerza también en las descripciones de algunos de los instru-

mentos diseñados e implementados para promoverla:



























Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
47
| Page 11 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Los proyectos en áreas estratégicas (pae) (…) tienen por objeto desarrollar
«clusters de conocimientos» en áreas y temas prioritarios establecidos en el
Plan Nacional de Ciencia Tecnología e Innovación (Codner, 2010)
… las Plataformas Tecnológicas, consistentes en unidades de apoyo a la inves-
tigación que se espera funcionen en red, orientadas a proveer infraestructura
de referencia en tecnologías de punta y a generar capacidades en campos del
saber (…) en los que su aplicabilidad práctica actual es incierta pero que resul-
tan vitales para aprovechar nuevas o eventuales «ventanas de oportunidad» o
posicionarse en la frontera tecnológica. (mincyt , 2011a)
Jas
y Kim (2009)
nen los imaginarios socio-técnicos como «for-


mas de vida y orden social colectivamente imaginados que se
ejan en el


-


cos». Los imaginarios no deben ser entendidos como «fantasía» o «ilusión»

ni residiendo en mentes individuales. Por el contrario, estos constituyen un

campo organizado de prácticas sociales, producen sistemas de
cado


que habilitan la interpretación colectiva de la realidad social (Castoriadis,



1987). En este aspecto, la capacidad de imaginar el futuro, de describir


futuros posibles y prescribir cuáles deben ser alcanzados, plantear metas


e intentar alcanzarlas, constituye un elemento crucial en la vida política y


social. Estas visiones sobre tecnología, las promesas y expectativas de fu-



turos posibles, y las políticas que se construyen sobre ellas, tienen el poder


de
el desarrollo tecnológico: informan y moldean trayectorias de


investigación e innovación hacia aquellas direcciones que consideran bue-



nas, deseables y/o posibles. De modo análogo, Emanuel Adler (1987) rescata


cómo las decisiones sobre caminos tecnológicos se encuentran ligadas a la



ideología de los actores involucrados y sus percepciones sobre la posibilidad


de establecer objetivos económicos y tecnológicos.



En el caso que nos ocupa, es posible observar cómo en las narrativas



de cien
funcionarios e instituciones de ct i la construcción de las



células madre como prioridad de investigación se atribuye a que estas


constituyen una «ventana de oportunidad» para acercar al país a la «fron-


tera tecnológica».


¿Pero qué visiones subyacen a estas narrativas? Por un lado, la noción


de aprovechamiento de las «ventanas de oportunidad» como estrategia de


desarrollo tecnológico autónomo fue propuesta por Carlota Pérez (Pérez y


Soete, 1988; Pérez, 2001). Esta implica que, frente a un cambio de paradigma

tecno-económico o de cambio de paradigma a escala disciplinaria, la cons-










































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
48
| Page 12 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
trucción de capacidades en campos cognitivos y tecnologías «emergentes»
constituye una ventaja a la hora de
nir nuevas direcciones de cambio


tecnológico. Para Pérez la fase de «despegue» constituye una instancia

privilegiada para el catch up tecnológico: es decir, realizar procesos de
aprendizaje y acumulación de conocimientos y capacidades en condiciones
ventajosas, en un momento en que las barreras de la entrada a la producción
y diseño de nuevas tecnologías son más bajas, con el objetivo de alcanzar
capacidades autónomas y establecer políticas de I+D que disminuyan la
distancia tecnológica entre las naciones desarrolladas y las naciones en
vías de desarrollo (Fressoli y Bortz, 2012).
Pero, a la vez, los mismos actores que impulsan la inversión estatal en
esta tecnología señalan que las aplicaciones de esta tecnología –caracteri-
zadas habitualmente como «revolucionarias»– son, aún, potenciales (coni-
cet, 2012; cacm-mincyt , 2009a; 2011; Mendizábal et al., 2014). La retórica
subyacente construye su carácter estratégico basándose en los
ios


futuros (potenciales) del desarrollo de conocimientos y técnicas que aún no


han sido lo s
emente conocidos y probados (Fressoli y Bortz, 2012).

En este sentido, las expectativas construidas sobre esta tecnología por

ct i, en relación a los futuros posi-


bles, al mismo tiempo que construyen el funcionamiento de la promoción de


la I+D en células madre como campo promisorio para el desarrollo, desacre-


ditan las aplicaciones y usos pretendidos actuales. En las secciones siguien-

tes veremos cómo los imaginarios socio-técnicos, a la vez que construyen


visiones acerca de las metas buenas y deseables de alcanzar, construyen


y advierten con respecto a los riesgos y peligros que pueden acompañar la


innovación si se «empuja» demasiado rápido (J
y Kim, 2009).

II.2.3. La realización del valor: las células madre en oferta emergente


En Argentina es posible
dos tendencias divergentes en la búsque-


da de generar valor económico a partir de material biológico.


Por un lado, el desinterés de las empresas de base tecnológica argentinas.



Los policy makers del sector ct i perciben una débil articulación entre las ca-


pacidades instaladas en ámbitos académicos y la demanda de las empresas


establecidas. Sostienen que la industria local no muestra gran interés en este



campo debido a la necesidad de una infraestructura adicional hospitalaria y la


incertidumbre con respecto al retorno de la inversión (mincyt , 2011b). Hasta



el momento, la mayor parte de la I+D en células madre se ha realizado en



centros e institutos de investigación, contando en su mayoría con nancia-


miento estatal y, en los escasos casos de participación de empresas, ésta























Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
49
| Page 13 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
se ha concentrado mayoritariamente en asociaciones con laboratorios o
instituciones públicas.
Se estima que algunos factores que pueden incidir negativamente en la
participación del sector privado son, en primer lugar, los problemas para
si la tecnología de células madre constituye un bien o un servicio.


Esto está directamente ligado a la posibilidad de producción a escala de


tratamientos y, en consecuencia, a las posibilidades de obtención de retornos

por la gran inversión en I+D. En segundo lugar, se encuentra el alto grado

de inversión y los elevados costos que implica la realización de ensayos
clínicos. En tercer lugar, la falta de un marco normativo establecido sobre
células madre. Así, tanto la falta de mecanismos regulatorios claros sobre
las «buenas prácticas» terapéuticas y de investigación sobre células madre,
como la falta de claridad sobre los mecanismos de propiedad intelectual
que podrían ser adoptados, genera un panorama incierto al respecto de las
posibilidades y formas de apropiación económica y/o social de estos desa-
rrollos. Esta situación tiene lugar, además, en el marco de una tendencia
general de participación del sector privado en las actividades de innovación
en la Argentina que se encuentra muy por debajo de lo que sucede en paí-
ses desarrollados e, incluso, en el promedio de Iberoamérica7 (r icyt, 2010).
No obstante, y por otro lado, en los últimos años sí han proliferado otras
iniciativas orientadas convertir en las células madre en fuente de generación
de ingreso económico.
En primer lugar, con el notable incremento del interés cientí o, médico

y comercial por las supuestas propiedades de las células madre de san-

gre de cordón umbilical8, una de las áreas que más proliferó en el sector
privado son los bancos que venden el servicio de colecta, procesamiento
y almacenamiento de las células de la sangre de cordón y placenta para
potencial uso autólogo y de familiares directos (Elustondo, 2011). Hasta el
momento, se registraron siete instituciones que brindan este servicio (uno
en Mar del Plata, otro en Rosario, Córdoba –con sede también en Mendo-
za– y el resto en la Ciudad de Buenos Aires). En 2015, guardar el cordón
umbilical en un banco privado costaba 15 mil pesos argentinos por primera
vez (aproximadamente 1500 dólares estadounidenses) y luego los usuarios
debían pagar por un servicio de mantenimiento mil pesos anuales. En 2015
se estimó, además, que 10 mil personas por año deciden guardar los tejidos
del cordón umbilical para prevenir emergencias futuras y que la tendencia
registra un incremento de un 15 por ciento anual (Garau, 2015). Por tanto,
en dicho año sólo los nuevos ingresos de material biológico a biobancos,
implicaron una facturación de 150 millones de pesos.


Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
50
| Page 14 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
En segundo lugar, puesto que se ha instalado en el público que «las cé-
lulas madre curan» (Stekolschik, 2008; Grippo, 2013), han aparecido:
instituciones médicas privadas que ofrecen tratamientos de autotrasplante de
células madre para tratar enfermedades como las parálisis por lesiones cere-
brales o de la médula espinal, las neurodegenerativas como la enfermedad de
Parkinson o trastornos metabólicos como la diabetes (Comisión Asesora en Te-
rapias Celulares y Medicina Regenerativa [cacm], 2009d).
Actualmente la oferta de intervenciones clínicas de células madre que se
ofrecen a los pacientes sin una investigación clínica sistemática pero con
Algunos autores incluso

hablan de la aparición de una «industria global» de intervenciones de células

madre que no han sido sometidas previamente a ensayos clínicos (McMa-


hon, 2014). McMahon (2014) estima que en los últimos quince años varios


cientos de miles de pacientes han recibido tratamientos experimentales con


células madre. Estas intervenciones, se ofrecen usualmente a precios que


oscilan entre 5 mil y 50 mil dólares estadounidenses, pero pueden llegar


incluso hasta los 100 mil dólares.


En Argentina, la Comisión Asesora en Terapias Celulares y Medicina Re-



generativa (cacm) del mincyt estima que alrededor de 10 instituciones se



encuentran ofreciendo tratamientos en Argentina que no han sido objeto de


ensayos clínicos, sino que se ofrecen como prácticas profesionales médicas.


En el país también se encuentran representantes de clínicas con sede en



otros países, principalmente China (Ferreras, 2012), que promueven viajes



para obtener tratamientos. Estas prácticas cuestan entre 50 mil y 100 mil



dólares y son habitualmente ofrecidas a pacientes con enfermedades huér-


fanas, incurables o con mínima expectativa de curación.



La creciente oferta de este tipo de tratamientos ha tenido, además, su


incidencia sobre los sistemas locales de salud. La negativa de seguros de


resultado, por


un lado, en demandas y pedidos de amparo por parte de diversos pacientes.

Entre la falta de espec
del marco regulatorio actual y las demandas


de los pacientes desesperados, en muchos casos los jueces han fallado a



favor de los pacientes y han obligado a las aseguradoras públicas y privadas


a cubrir los tratamientos experimentales (Arzuaga, 2013). En otros casos,



ante la negativa de los sistemas de salud previsionales se han impulsado


campañas solidarias de recolección de fondos para ayudar a niños enfermos



a costear sus viajes a China, Estados Unidos u otros destinos, los cuales













































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
51
| Page 15 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
han gozado de intensa cobertura mediática (Ferreras, 2012; «Furor solidario
en las redes sociales por Helenita», 2014, Clarín; «Se realizó con éxito el
trasplante de Helenita», 2014, La Nación). Profundizaremos sobre este punto
a continuación.
III. La construcción de nuevas subjetividades y expectativas
A diferencia de otros países de la región como Brasil9, en Argentina las células
madre no han suscitado aún grandes controversias a nivel de la opinión públi-
ca. No obstante, habitualmente se presenta una cobertura excesivamente opti-
mista acerca de las potencialidades sobre el almacenamiento de células madre
de sangre de cordón umbilical para uso autólogo y sobre las terapias con cé-
lulas madre. A continuación, analizamos a) la construcción de expectativas en
el caso de las células de cordón, b) las esperanzas brindadas por tratamientos
experimentales llevados a en los márgenes del marco regulatorio vigente, y c)
la transformación del sentido de «riesgo», de la enfermedad a la cura.
III.1. Bancos privados de células de cordón: promesas y tentativas
individuales de anticipar y prevenir la enfermedad
El creciente interés por las potenciales capacidades terapéuticas de las célu-
las madre se
por ejemplo, en el almacenamiento en bancos priva-

dos de células progenitoras hematopoyéticas de sangre de cordón umbilical


para uso autólogo por parte de madres y padres.

Frente a esto, hay posiciones encontradas. Por un lado, estas expecta-

tivas son ampliamente propiciadas desde los bancos privados de células


madre. La oferta y publicidad de estas instituciones se encuentra disponible

en consultorios ginecológicos, páginas web de centros médicos, así como

en publicaciones gr cas y en Internet sobre maternidad y salud, apelando

a la responsabilidad individual de los nuevos progenitores sobre la salud


futura de sus hijos. Se apela, además, al carácter único de la posibilidad
de los mismos de garantizar ese acceso, en la medida que dicho material
biológico sólo puede ser recolectado en el momento del parto.
Por ejemplo, según el director de uno de los bancos de células madre
privados más grandes del país, «el mundo de posibilidades que inauguran
las stem cells es ilimitado» (Elustondo, 2011). Destaca su utilización para el
tratamiento de enfermedades como leucemia, algunas enfermedades meta-
díaca e infarto


de miocardio. Estas empresas sostienen la utilidad del almacenamiento de


material celular sobre el supuesto de la potencial aplicación de tratamientos:




















































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
52
| Page 16 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Guardar células no es un acto egoísta, sino protección biológica para hijos
y familia. Uno no está privando al banco público de una muestra que el Estado
guardaría para quien la pudiera necesitar. Se está guardando algo que iría a la
basura (Elustondo, 2011).
Siguiendo a Rose (2012), es posible ident
ar en este punto una instan-

cia de «subjetivación»: desde una concepción de «ciudadanía biológica»

(Rose y Novas, 2004) se apela a una
de las obligaciones,

derechos y expectativas de los seres humanos en relación con su vida y

su enfermedad. Por tanto, se asigna sobre los padres la «responsabilidad»


de tomar la decisión que permita (potencialmente) proteger la salud de sus


hijos (Fig. 1-3). Esta decisión es, además, de carácter preventivo. Frente


a un recién nacido, se parte del supuesto de incertidumbre sobre el futuro,


que siempre se encuentra en riesgo, y de que los pacientes nunca saben

lo
ciente acerca de lo que podrían y deberían estar haciendo (Dumit,


2012). Aquí la enfermedad se generaliza: en la medida que todos somos o

seremos potencialmente enfermos la noción de riesgo inaugura una inter-


vención sin
(Beck, 1998; Rose, 2012; Dumit, 2012). Estas iniciativas, por

lo tanto, no brindan cura, sino –esencialmente– una oportunidad de estar

preparadas para la «medicina del futuro» (Krmpotic, 2011). Se coloca el foco

en la construcción de consumidores activos que eligen y usan activamente
la medicina, las biociencias y los tratamientos disponibles para «maximizar»
su vitalidad (Rose, 2012).
Figur as 1 a 3. Publicidades de tres bancos de células madre
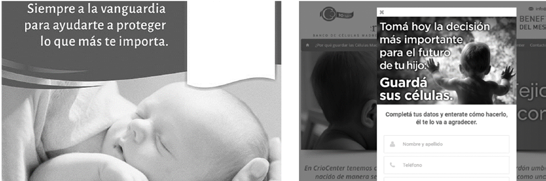
Figur a 1. «Siempre a la vanguardia para
Figur a 2. «Tomá hoy la decisión más
ayudarte a proteger lo que más te importa» importante para el futuro de tu hijo:
guardá sus células»
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
53
| Page 17 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…

Figur a 3. «Desarrollando herramientas para la medicina regenerativa y para el
futuro de quiénes más querés».
Fuent e: páginas web de biobancos. Nombres de empresas fueron anonimizados.
Guardar las células madre de sangre de cordón es construida, enton-
ces, como una alternativa tecnológica incierta para riesgos futuros también
inciertos, puesto que el almacenamiento de sangre de cordón umbilical o
placenta no garantiza el acceso posterior a tratamientos con el material
celular guardado.
Posiciones contrarias advierten en contra de estos servicios. En la contro-
versia sobre los modos y criterios para el almacenamiento y utilización del
material celular (público o privado), desde la Comisión Asesora en Terapias
Celulares y Medicina Regenerativa del mincyt , advierten contra los riesgos
y critican que los bancos privados «realizan una propaganda engañosa al
exaltar las potencialidades curativas en varias enfermedades cuando toda-
vía no existen evidencias clínicas para ello», en la medida que todo uso de
células madre de la sangre de cordón umbilical, que no sea el trasplante
de medula ósea, es experimental (cacm-mincyt , 2009c). Esta posición es
compartida por el Banco Público de Sangre de Cordón del Hospital Garra-
han10, desde donde se refuerza una concepción del material celular como
bien público y la instalación de un sistema «solidario» de donación y utili-
zación11 (Stekolschik, 2008; Waldby y Mitchell, 2006). No obstante, a pesar
de la posición cial sobre esta materia, la regulación sobre la temática, de


carácter aún reciente, no ha logrado interponer demasiadas restricciones a
la oferta de tales servicios (Krmpotic, 2011).


Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
54
| Page 18 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
III.2. Tratamientos experimentales: ofertas arriesgadas
en los márgenes del marco regulatorio
En los últimos años, además, han surgido en el país distintas instituciones
médicas privadas que ofrecen tratamientos de autotrasplante de células ma-
dre como alternativas terapéuticas para enfermedades neurodegenerativas,
metabólicas, entre otras, retroalimentadas por la idea instalada en la opinión
pública «que las células madre curan» (Stekolschik, 2008; Morando, 2006;
«Argentina, meca del turismo de salud trucho», 2009,
). Desde la co-

misión asesora de células madre del mincyt se estiman en la actualidad al-


rededor de diez centros que ofrecen dicho tipo de terapias en Argentina, el

principal de ellos ligado a una universidad privada, y/o que representan ins-

tituciones que los ofrecen en el exterior, sobre todo en China y en Estados
Unidos. Estas prácticas, de carácter oneroso, usualmente son ofrecidas a
pacientes con enfermedades huérfanas, sin cura, o con escasa expectativa
de curación, y se convierten en «meta de peregrinajes esperanzados en el
mundo entero en pos de curas para lo que sea, desde lesiones de médula
hasta mal de Alzheimer» (Rose, 2012:30).
La amplia difusión que tienen los tratamientos con células madre en la
prensa –incluyendo campañas solidarias de colecta de fondos para ayudar
a niños a cubrir los costos de los mismos– ha tenido gran repercusión en
la opinión pública y en las decisiones de pacientes (Ferreras, 2012; Grippo,
2013; «Furor solidario en las redes sociales por Helenita», 2014, Clarín; «Se
realizó con éxito el trasplante de Helenita», 2014, La Nación). Asimismo,
ante la negativa de los seguros de salud de cubrir estos tratamientos, se
registran diversos casos de demandas y solicitud de amparos de parte de
pacientes con riesgo de vida y sus familias, accionando contra el Estado u
obras sociales por su cobertura. Frente a estas demandas, y ante la falta de
un régimen regulatorio especí
son varios los casos en que jueces han

fallado a favor de la transferencia de fondos desde el sistema público a los

centros médicos que ofrecen terapias experimentales (Arzuaga, 2013; «Las

prepagas también deben costear los tratamientos con células madre», 2011,

Diario Judicial).
Los pacientes juegan aquí un papel notable en la economía organizada en
torno a la generación de renta a partir de material biológico (Novas, 2006). És-
tos llegan a los tratamientos en experimentación mediante recomendaciones
de amigos o familiares, información en la web, foros de discusión, derivación
de otros profesionales, impulsados por el carácter apremiante de sus propias
dolencias o de parientes cercanos. Estas expectativas adquieren materiali-
dad económica, en la medida que demandan de la ciencia la posibilidad de
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
55
| Page 19 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
tener curas presentes o en el futuro cercano (Novas, 2006). No obstante, en
los casos de demanda de tratamientos experimentales no se registra una
esperanza organizada sino una aproximación de carácter individual. Operan
en estas instancias juicios individuales sobre la aceptación de estas terapias
por la creencia en la cura, que prevalece a cualquier otro tipo de evaluación
política o legal (Krmpotic, 2011), en una negociación personal y


privada entre el saber del carácter terminal o incurable de una dolencia y los


riesgos de los tratamientos. Los resultados obtenidos en los distintos casos


se muestran disímiles, oscilando entre testimonios de mejoras a partir del tra-

tamiento y las denuncias por engaño y estafa (Krmpotic, 2011; Grippo, 2013).

Frente a esto, en Argentina se observa una amplia coincidencia de pos-

turas tanto desde el mincyt ,
y los organismos nacionales de

regulación de medicamentos y de ablación y trasplante en el carácter pro-


blemático que esto supone, en términos de las expectativas generadas en


los pacientes y las promesas de curación.


Dichas instituciones [clínicas] se presentan ante potenciales pacientes y a

sus familiares con promesas irrealizables de curación y mejora de las enfer-

medades a pesar de la evidencia de que muchas de las prácticas ofrecidas

no poseen efectos terapéuticos comprobados ni siquiera en modelos animales

(cacm-mincyt , 2009b).
La Comisión Asesora en Terapias Celulares y Medicina Regenerativa, que
nuclea esta pluralidad de actores, ha publicado numerosos comunicados
sobre este tema, advirtiendo que, si bien se ofrecen en el mundo terapias
para tratar distintas patologías mediante la utilización de células madre,
sólo cuentan con la aprobación de los organismos de control establecidos: el
trasplante de células madre de médula ósea, sangre periférica y cordón umbi-
lical; y el autotrasplante de células madre de médula ósea y sangre periférica
para tratar enfermedades de la sangre. El resto de los tratamientos no ha de-
mostrado la
ni las condiciones de seguridad apropiadas para su uso


terapéutico en seres humanos (cacm-mincyt , 2009b; 2012a).


Estos actores señalan el desequilibrio económico que esto supone tanto

a nivel individual de los pacientes como en términos colectivos en el sistema

público de salud, derivados de los problemas y tensiones por el nanciamien-

to de tratamientos onerosos e inciertos para una minoría vs. tratamientos

para una mayoría de la población.
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
56
| Page 20 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Por otro lado, en contraposición al carácter individual y privado de las
decisiones de los pacientes que se someten a estos tratamientos, la estra-
tegia de las asociaciones de pacientes locales (tanto desde la Federación
Argentina de Enfermedades Poco Frecuentes, que nuclea más de 30 asocia-
ciones miembro y de 20 grupos de pacientes, como de aquellas que pueden
ser afectadas por terapias avanzadas) ha sido opuesta: lejos de abogar por
alternativas de des-regulación que permitan una difusión más amplia de es-
tos tratamientos, se han inclinado por generar procesos de concientización
sobre enfermedades, difundir sobre los riesgos de las terapias experimen-
tales, denunciar la construcción de «expectativas desmesuradas» desde la
cobertura mediática («Consiguieron devolverles la visión a pacientes…»,
Clarín, 2014; «Levántense y anden», Página 12, 2015) y asesorar a aquellos
que buscan este tipo de alternativas.
En este aspecto, en el rol de las asociaciones de pacientes en la «econo-
mía política de la esperanza» (Novas, 2006) se destaca su alianza con los
cientí os locales: por un lado generando registros locales de patologías,

armando historias clínicas, alimentando bases de datos internacionales,

aportando datos y dialogando con laboratorios (Braga Menéndez, 2013) y,
por el otro, promoviendo activamente el desarrollo de nuevos estudios vali-
dados por medio de ensayos clínicos:
aprobados por la autoridad reguladora competente, con consentimiento informa-
do donde se detalla todos los efectos adversos que podría tener el estudio, (…)
gratuito para los pacientes y [donde] (…) el paciente tiene un seguimiento deta-
llado de su evolución y posibles complicaciones durante años (f adepof, 2014).
Así, frente a la construcción de expectativas aún no probadas de curación,
estas asociaciones respaldan la construcción de una regulación «basada
en la evidencia» que promueva la investigación básica y clínica y sancione
las prácticas experimentales realizadas por fuera de los ensayos clínicos
(f adepof, 2014; f il , 2014). Han conformado, bajo el impulso del ministerio
de Ciencia y Tecnología, una red para coordinar esfuerzos, promover la
legislación en el tema, posicionar en la agenda pública e informar a los
pacientes y sus familias acerca de los riesgos de las terapias con células
madre de carácter experimental.
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
57
| Page 21 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
III.3.
La transformación del riesgo: de la enfermedad al peligro de la «cura»
En Argentina, la construcción de expectativas sobre los
de las cé-


lulas madre ha tenido una doble cara: por un lado desde las narrativas desde


medios de comunicación, en la publicidad de bancos privados y clínicas, y


pacientes en términos individuales, que trascienden en la opinión pública;

por el otro, la expectativa también permea al discurso estatal, de

y de asociaciones de pacientes, que apuestan a esta tecnología suponiendo

su aplicabilidad y sustentabilidad. En este segundo caso, la posición sobre el


carácter «bueno y deseable» de las células madre, y el discurso que sostiene


de qué manera construir una trayectoria nacional de innovación en ella (y de


qué manera no) articula no sólo futuros posibles sino también advierte sobre

Así, mientras que, por un lado, se ha construido cierta percepción de «ino-

cuidad» de las terapias con células madre, condensada en la premisa de que

«las células madre curan» (Stekolchik, 2008; Gripo, 2013; Fernández, 2012),

por el otro, actores estatales y cientí os ligados a la temática advierten,


además de su efectividad aún no probada, los problemas de bioseguridad


de las prácticas realizadas en las clínicas y sus riesgos; por ejemplo, de


crecimiento de tumores por diferenciación celular y contaminación, así como


otros efectos colaterales actualmente desconocidos (cacm-mincyt , 2009b;


Kolata, 2016). En este punto, la noción de riesgo que se construye desde



instituciones cien
s y organismos de regulación se contrapone a aquella


propuesta, por ejemplo, desde los biobancos privados: ya no es el riesgo





a un futuro en el que todos podemos ser potencialmente enfermos (véase



Hallowell & Lawton, 2002; Dumit, 2012), sino el riesgo presente, inherente



a las propias terapias, que no se ajustan a los criterios de seguridad y
-

ciencia de la medicina basada en la evidencia. La responsabilidad individual

de los pacientes aparece en tensión, como una negociación personal entre

riesgos en competencia: riesgos presentes y futuros, entre la enfermedad y

el riesgo del tratamiento (Hallowell & Lawton, 2002)

En el apartado siguiente veremos cómo, aun cuando estas prácticas te-


rapéuticas pueden entrar dentro del margen de la «legalidad», su carácter

ético o legítimo dentro de la práctica médica se ve objetado.

IV. La regulación: entre el riesgo y la generación de valor bioeconómico

IV.1. La regulación actual sobre células madre en Argentina


¿Cómo se
esta divergencia entre lo legal y lo considerado ético en

los tratamientos con células madre? ¿Cuáles son las características de la re-








Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
58
| Page 22 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
gulación local? Actualmente en Argentina no existe una normativa


para las terapias con células madre. La regulación actual, de carácter parcial,


se encuadra en un conjunto de normativas que incluyen la Ley de Medica-


mentos (1964), la Ley de Ejercicio Profesional de la Medicina (1967) y la Ley

de Trasplantes (1993). Todas estas dictadas con anterioridad al desarrollo

de los tratamientos con células madre, no prevén las
de los

mismos.


Al mismo tiempo, la normativa especí a existente no tiene el rango de


ley sino de resoluciones ministeriales o disposiciones de organismos regu-



latorios. A través de la Resolución 610/07, el Ministerio de Salud determinó

que el organismo que debía entender que las actividades relacionadas con

el uso de células humanas para implantación era el Instituto Nacional Central

Único Coordinador de Ablación e Implante (incucai). En el Decreto 512/95,


se determinó que sólo el trasplante de médula ósea (alogénico o autólogo)

puede ser considerado una práctica corriente y aceptada, mientras que

cualquier otra terapia celular es considerada práctica experimental y debe

ser presentada ante las autoridades sanitarias para su registro y evaluación.

Dadas sus características especí
las terapias celulares se encuentran

en una zona gris entre ser considerados procedimientos o ser considerados

productos. La de
ón entre una u otra tiene importancia sobre las alternati-


vas que puede adoptar la regulación local. En el estado actual, la asignación

del incucai como organismo competente en la materia acerca la regulación

argentina al primero de los enfoques. Sin embargo, la tendencia actual

marcada por las experiencias de regulación de Estados Unidos y la Unión

Europea, se orienta hacia la segunda posición (Rosemann et al., 2016). En


este segundo enfoque, las terapias con células madre serían consideradas
productos antes que procedimientos y deberían enmarcarse en un proceso
de aprobación similar al de los medicamentos biológicos, que requiere la
realización de ensayos clínicos controlados. De esta manera, si en el debate
actual sobre una legislación especí
las posiciones se inclinan hacia esta

tendencia, la autoridad competente local sería la Administración Nacional de

Medicamentos, Alimentos y Tecnología Médica (anmat ), no el incucai.

Por otra parte, el carácter federal del sistema de gobierno en la Argentina
implica que las provincias retienen –entre otras potestades– la autoridad y
el poder de policía sanitario dentro de su propia jurisdicción. Esto conlleva
que las autoridades regulatorias nacionales sólo tengan jurisdicción cuando
los productos realizan tránsito entre las distintas provincias o son impor-
tados/exportados. En consecuencia, si un procedimiento es aplicado o un
producto es elaborado y consumido en el marco de una misma provincia, la
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
59
| Page 23 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
regulación aplicable es la dictada por el gobierno provincial correspondiente
(Arzuaga, 2013).
El estado actual del marco normativo genera pues un margen disponible
para la oferta de tratamientos experimentales por fuera de los criterios de la
medicina basada en la evidencia. Mientras que la traducción clínica y oferta
de tratamientos y productos en base a células madre quedan amparados
bajo la ley en tanto procedimiento de avanzada en el marco del ejercicio
profesional de la práctica clínica (equiparada, por ejemplo, a una técnica
quirúrgica estándar), el carácter federal del sistema argentino de gobierno
inhibe a las autoridades regulatorias nacionales a actuar de
en los


casos en los que el tratamiento es realizado en una clínica y permanece en


su propia jurisdicción. De este modo, en caso de tratarse de procedimientos

realizados al interior de centros médicos que cuentan con autorización de
la autoridad sanitaria provincial, es ésta la que se reserva el derecho de
mantener o derogar dicha aprobación.
A la vez, mientras que según la resolución 610/07 todas las prácticas
experimentales con células madre deberían ser autorizadas y monitoreadas
por el incucai, en la práctica este organismo carece de poder de policía para
hacer cumplir la normativa, inhibiendo su capacidad de limitar la oferta de
tratamientos experimentales.

con fuerza de ley c
gura una situación de facto en la cual no existe un


control efectivo sobre las nuevas terapias celulares.


El caso argentino hasta el momento corrobora las explicaciones en clave


de «vacío de gobernanza» propuestas por diversos autores para analizar


la divergencia regulatoria en células madre en países como Brasil, India,


China (Padma, 2006; Sleeboom-Faulkner y Patra, 2008; Tiwari y Raman,



2014; McMahon, 2014). Estos estudios han mostrado una oscilación entre


la ausencia total de regulaciones para las aplicaciones clínicas de células


de los marcos regula-



torios en distintos países (McMahon 2014). Para Sleeboom-Faulkner y Patra



(2008) las regulaciones de células madre en muchas sociedades incluyen


sólo formas «suaves» de gobernanza, usualmente directrices, que no están



respaldadas por la ley y carecen de las infraestructuras y los procedimientos



administrativos para garantizar la efectiva ejecución. Señalan, además, que

en años recientes ha habido un giro creciente hacia la adopción de normas

más «duras» y comprehensivas.

En este sentido, en Argentina las discusiones y acciones para generación


de una normativa especí ca ha sido impulsada desde la Comisión Asesora

en Terapias Celulares y Medicina Regenerativa dependiente del ministerio




















































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
60
| Page 24 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
de Ciencia y Tecnología, que nuclea cientí cos, abogados, bioeticistas, es-

pecialistas en salud pública, representantes de organismos regulatorios, del
incucai y del único banco público de células madre de cordón.
Creada en el 2006, la comisión tiene como objetivo asesorar en asuntos
referidos a la regulación, promoción y difusión de la investigación y terapias
clínicas que implican el uso de esta tecnología y trabajar en la elaboración
del marco jurídico que regule investigaciones y tratamientos con células
madre. Con este segundo objetivo, es decir, elaborar una normativa espe-
cí ca que provea de un marco claro para los tratamientos experimentales

y sobre las normas de traducción clínica y posterior comercialización, se
trabajó en colaboración con los distintos actores locales vinculados al campo
de la medicina regenerativa, se establecieron vinculaciones con agencias
de medicamentos y productos sanitarios y se consultaron regulaciones de
otros países (Arzuaga, comunicación personal, 2015).
En este momento está en elaboración un proyecto de ley de terapias
avanzadas, que incluye terapia génica, terapia celular e ingeniería de tejidos.
Éste se orienta a «garantizar la seguridad, calidad y
ia de los produc-


tos y tratamientos que se prescriben a los pacientes». Según la Comisión

Asesora en Terapias Celulares y Medicina Regenerativa


el marco normativo debería incluir una ley general, un marco regulatorio y un
sistema de normas blandas tales como la creación de un Comité de Ética Na-
cional, integrado por miembros de cada provincia, el fortalecimiento de la co-
municación e información a las asociaciones de pacientes y a las sociedades
médicas (mincyt , 2016).
Se espera que la sanción de un marco normativo especí
pueda

el tratamiento de las prácticas a nivel nacional (evitando diferencias inter-ju-


risdiccionales), brindar garantías a los participantes de estudios clínicos


en el cumplimiento de derechos personalísimos y que aporte fundamentos


legales sólidos para la scalización. Siguiendo el posicionamiento que ha


adoptado la Comisión a través de comunicados sucesivos, es posible prever

que un proyecto en esta línea incluya entre sus lineamientos generales: a)

que las terapias aún no aprobadas se suministren en el marco de ensayos
clínicos, plasmados en protocolos dirigidos por investigadores reconocidos
y aprobados por un comité de ética y por la autoridad regulatoria; b) que,
por tanto, dichos tratamientos aseguren la gratuidad para los pacientes y
establezcan previsiones
para la protección de los grupos vul-


nerables; c) la rma de consentimiento informado por parte de los pacien-









Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
61
| Page 25 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
tes y la recepción de información sólida cientí amente sobre los riesgos

involucrados; d) la necesidad de que las terapias avanzadas obtengan un

registro sanitario previo a su comercialización mediante el cumplimiento de
requisitos de aprobación (estudios pre-clínicos y clínicos, cumplimiento de
Buenas Prácticas Clínicas y de Manufactura). Es dable esperar, además, que
la regulación estipule esquemas de prohibiciones y sanciones, en materia
tanto civil como penal, para los profesionales de la salud y establecimientos
que no se adecuen a las pautas.
IV.2. Entre el riesgo y las ventanas de oportunidad
Desde los organismos de políticas ct i en Argentina, la confección de una
normativa que regule la investigación clínica, tratamientos y laboratorios que
fabriquen productos celulares es considerada una acción prioritaria (mincyt ,
2012). La construcción de este marco normativo enfrenta varios desafíos: de-
tipos celulares y técnicas de manipulación, buenas prácticas de inves-

tigación y terapéuticas, formas de vinculación con los pacientes (consenti-

miento informado, donación de material celular), la obtención, tratamiento y

guarda de muestras, así como también generar consenso sobre la autoridad

de aplicación de esta normativa. Este es un momento de incertidumbre al res-
pecto de cuáles van a ser las instituciones y las normativas que van a estruc-
turar la investigación y la aplicación terapéutica de las células madre en los
próximos años. Aún se encuentra en debate si la tecnología de células madre
constituye un bien o un servicio, una droga o un tratamiento y cuáles son los
niveles de manipulación celular para considerar uno u otro. Esto último gene-
ra tensiones entre aquellos que sostienen la incumbencia del incucai como
autoridad de aplicación y aquellos que sostienen la competencia de la anmat
sobre la materia. A partir de los comunicados del mincyt , puede interpretarse
una inclinación hacia esta última posición, al considerar a las células madre
un «producto médico», aunque manteniendo la autoridad del incucai en lo



Esta posición parece seguir la tendencia de las posturas que han adop-


tado tanto los Estados Unidos como la Unión Europea a través de las


Regulation For Human, Cellular and Tissue Products (hct /ps) y Advanced


Therapy Medicinal Products (at mp), respectivamente, ambas de 2007, en la


consideración de las células madre como medicamentos de tipo biológico,




estableciendo su jurisdicción bajo el ámbito de la autoridad sanitaria. Éstas


establecen una distinción basada en el riesgo que distingue entre células


madre mínimamente manipuladas para uso autólogo de células madre


más que mínimamente manipuladas para uso alogénico. Mientras que las






































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
62
| Page 26 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
primeras no son consideradas una droga y se rigen por las normativas es-
tadounidense y europeas de regulación de tejidos humanos, no requiriendo
aprobación previa de la autoridad sanitaria, las segundas son consideradas
drogas biológicas (Estados Unidos) o productos medicinales (Unión Europea)
y son sujetas a la aprobación previa de la autoridad sanitaria correspondiente
(Food and Drug Administration, f da o European Medicines Agency, ema,
respectivamente). Estas disposiciones involucran el requerimiento de una
amplia evidencia preclínica y el uso obligatorio de los ensayos clínicos de
fase i-iii
l. Se




edicina basada


en la evidencia y los estándares metodológicos de seguridad y
acia de


la industria farmacéutica (Sleeboom-Faulkner et al., 2016).


Otro objetivo clave de la f da también está en generar un proceso de ar-




monización internacional, lo cual se
eja en la colaboración con las auto-


ridades reguladoras de la Unión Europea y Japón, a través del International


Conference on Harmonisation of Technical Requirements for Registration of


Pharmaceuticals for Human Use (ich). Esto tiende a generar convergencia


en los procedimientos reglamentarios para productos terapéuticos con célu-


las madre. Pero, a la vez, también genera un incremento en los costos de los


tratamientos, elevando las barreras a la entrada para investigadores clínicos



independientes, pequeñas empresas biotecnológicas y países en desarrollo.



Lo que se observa en este punto en células madre es un
icto entre


dos dinámicas centrales: los intentos hacia la armonización vs. un proceso de



diversi
ción regulatoria (Rosemann et al., 2016). Algunos autores señalan



que la adhesión a las normas de regulación armonizadas internacionalmente


suele no ser propicia para generar ingresos en mercados nacionales a partir


de material biológico, frente a los altos costo de investigación y autorización

de venta, regímenes restrictivos de los derechos de propiedad, entre otros,


que traen aparejados los procesos de armonización internacional (Birch,


2012). Así, la adhesión o no de diversos países a normas internacionales

estandarizadas se asocia a la orientación
para la producción y co-


mercialización de productos y servicios en base a material celular.

Frente a esto, es posible ident car a nivel internacional diversas orienta-

ciones: por un lado, hacia el fomento de negocios y obtención de ingresos en

mercados locales. De un modo explícito, Japón se alejó de los estándares


internacionales m
cando la regulación para la habilitación temprana de

tratamientos y generando un nuevo modelo regulatorio. Ésta forma parte

de una estrategia política para fomentar la competitividad de la innovación



doméstica y oportunidades comerciales en relación a recursos y ambiciones







































































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
63
| Page 27 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
locales (Sleebom Faulkner et al., 2016). Distintos son los casos de China
e India, que aunque han elaborado normativas explícitas en línea con las
tendencias de la ich, de manera implícita han tolerado el aprovechamiento
de oportunidades de negocio locales en las áreas grises de la regulación. La
proliferación de ofertas de tratamiento no forma parte así de una estrategia
deliberada, sino que tiene lugar en un escenario de demoras en la normativa,
s de agencias


estatales, laxitud en la aplicación de la ley, entre otras, que hacen pensar


en formas de intervención estatal a través de la no decisión (Bachrach y

Baratz, 1963) y la exibilidad en la implementación como táctica regulatoria



(Sleeboom-Faulkner y Patra, 2008; Rosemann, 2014).



Por otro lado, se encuentra una tendencia hacia la armonización norma-


tiva, orientada hacia la colaboración internacional de la I+D e investigación


clínica y actividades económicas para el mercado global (Sleeboom-Faulkner


et al., 2016). A nivel mundial, las presiones para la armonización por parte de



países como Estados Unidos y la Unión Europea, marcadores de tendencia


en temas de regulación, muestran un proceso in the making de elevación de



las barreras al ingreso. Esta alternativa regulatoria implica mayores costos


para la puesta a punto de los productos biológicos domésticos, en la medida


que para alcanzar estándares de seguridad es necesario atravesar ensayos


clínicos rigurosos en diversas fases. En este clima de
de



los estándares regulatorios, la tendencia en Argentina se inclina hacia esta



segunda alternativa.




Esta posición es consistente con el imaginario socio-técnico construido



desde las políticas de ct i en Argentina que considera a las células madre


como estrategia de posicionamiento nacional en la «frontera del conocimien-

to» cientí
Desde las autoridades locales se percibe que la

o exibilización regulatoria afecta la credibilidad de las terapias con células

madre y se desestima que una aprobación rápida de mercado pueda ge-

nerar ventajas económicas. Considerando los riesgos y la falta de certezas

sobre seguridad y
ia, la idea que subyace es que los tratamientos no

probados desvían recursos y credibilidad de actividades de I+D que pueden


ser de mayor valor a largo plazo.


Por lo tanto, la apuesta a esta tecnología en su estado emergente, como

«ventana de oportunidad», se traduce en distintos modos de intervención

estatal (Jasano y Kim, 2009): focalizar la política en la promoción de la I+D

en centros de excelencia; cristalizar acciones para respaldar estas políticas


(fomento a la I+D, regulatorias y de alineación de actores y redes); encuadrar

los riesgos en la advertencia sobre las terapias experimentales; articular con-




































Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
64
| Page 28 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
troversias sociales y técnicas (sobre los riesgos y bene
os de la tecnología,

sobre su categorización como producto o procedimiento) y orientar recursos


y acciones hacia su clausura; generar alianzas con actores relevantes en la
sociedad civil, como las asociaciones de pacientes, entre otras.
De este modo, el direccionamiento de las acciones estatales sobre las
células madre se orientan a moldear la trayectoria de innovación hacia una
alternativa tecnológica construida como «buena, deseable y posible» por
cientí os, funcionarios ct i y con el respaldo de asociaciones de pacientes.

La tentativa de regulación impulsada desde el mincyt se presenta como

una forma de establecer una gobernanza más dura en la mediación entre
la expectativa de los pacientes, la oferta de tratamientos experimentales
lucrativos (por fuera del sendero «bueno y deseable») y el riesgo inherente
a estos tratamientos, cuya
ia y seguridad no se encuentran probadas


en base a los estándares de la medicina basada en la evidencia.

VI. Conclusiones


Las células madre y terapias celulares en Argentina son actualmente con-
sideradas por
y tomadores de decisiones sobre políticas ct i una


temática prioritaria en el ámbito de la investigación biomédica. Esta tecnolo-


gía es percibida como una ventana de oportunidad para el posicionamiento


nacional en una tecnología emergente.

Así, en los últimos diez años se han alineado un conjunto de acciones

institucionales, de
o y regulatorias con la nalidad de construir

capacidades endógenas en la temática, conforme a estándares internacio-

nales. A la vez, se ha realizado una fuerte acción para alertar frente a las

expectativas construidas sobre los
aún potenciales de esta tecno-

logía y encuadrar los riesgos inherentes a aquellos procedimientos que no


cuentan con evidencia cie
tenida en ensayos clínicos randomizados.


Se considera que sólo los productos desarrollados dentro de los estándares


de la medicina basada en la evidencia tienen posibilidades generar ingreso

y crecimiento (bio)económico.


El discurso público establece así un parteaguas entre aquellos productos


o servicios desarrollados localmente en un área gris de la práctica clínica, de


las líneas de investigación y desarrollo promovidas por el Estado y ejecuta-


das por cientí os prestigiosos en unidades de I+D, en cumplimiento de las


normas internacionales de investigación clínica y aprobación de tratamientos.

Se sostiene que esta segunda vía abrirá la posibilidad de generar productos

que se integren en el mercado de células madre a nivel global.











Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
65
| Page 29 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
es orien-

tadas a moldear la trayectoria de esta tecnología en el país y a clausurar las



controversias sociales y técnicas sobre la misma. En particular, mediando



entre las expectativas de los pacientes, el riesgo de las terapias experimen-


tales, y la construcción de capacidades en investigación y terapéuticas en el



país en base a criterios de seguridad y cacia internacionales. Se percibe,


además, que las directrices éticas y legales, y las actividades de cientí cos,


biobancos, rmas y asociaciones de pacientes deben estar alineadas para


poder desarrollar el campo de células madre en esta dirección. Esta alianza


queda en evidencia a partir de la composición de la Comisión Asesora en




Terapias Celulares y Medicina Regenerativa, que se ha convertido en este


momento en un organismo interactoral de gobernanza en la materia para la



promoción de la tecnología en esta dirección.


No obstante, la producción y comercialización de productos en células



madre por parte de empresas de base tecnológica argentinas aún tiene un


largo camino por recorrer. Por un lado, en la medida que recién se están


desarrollando los primeros protocolos de investigación clínica. Por el otro,



en tanto persista la incertidumbre al respecto de la escalabilidad de los



productos, comercialización, estándares de seguridad y protección de pro-




piedad intelectual, es probable que el involucramiento de las empresas de

base tecnológica continúe siendo débil. Contrariamente, la incertidumbre

sobre posibles aplicaciones, retorno de la inversión y regulación ha jugado


de forma inversa en los casos de biobancos privados y clínicas de terapias

celulares experimentales, que han convertido el riesgo de la enfermedad y

las esperanzas de curación en lucrativas oportunidades de negocio.


Por otro lado, aunque la principal fuente de inversión en la construcción

de capacidades de I+D continúa siendo el sector público, para los organis-

mos nacionales de ct i las capacidades terapéuticas de las aplicaciones
se encuentran todavía en el plano del
potencial, en proceso de


investigación. En este punto, es posible advertir que la construcción de es-


peranzas por los posibles
ios de la tecnología no se limita a la órbita


de pacientes, biobancos privados, clínicas y medios de comunicación. Este

discurso también permea al Estado, que apuesta fuerte a este desarrollo en

base a expectativas de aplicabilidad. En este sentido, la construcción del


discurso estatal sobre esta tecnología ha focalizado más en la promoción


de la I+D como «oportunidad» y la limitación de tratamientos experimentales

que sobre la posibilidad de acceso terapéutico local a dichos tratamientos.

Esto abre la puerta a cuestionar, en el apoyo estatal a la construcción de
capacidades en células madre, ¿en qué medida la «oportunidad» va más allá
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
66
| Page 30 |
BORTZ, GABRIELA et al. | ENTRE OPORTUNIDAD Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
del posicionamiento en la «frontera de la ciencia» hacia una comprensión
más amplia sobre su utilidad social local? ¿Cómo las células madre como
problema de I+D se construyen como prioridad más allá del laboratorio? Pa-
sar de considerar esta tecnología como prioridad de I+D hacia una tecnología
estratégica implicaría una
más clara de los objetivos políticos y


sociales de la tecnología, pensando la construcción de la utilidad social de


conocimientos y tecnologías impulsados por el Estado desde el momento del

ácticas de I+D.


Resta aquí como desafío trascender la concepción de las células madre


más allá de las políticas de innovación, y considerar una posible articulación


con políticas más amplias de desarrollo, en particular en su articulación con


el sistema de salud. En la instancia actual de construcción de normativa in


the making y de alineación de actores locales será necesario pensar cómo


la estrategia adoptada permitirá asegurar que el fruto de estos esfuerzos




de I+D nacional, bajo los más estrictos parámetros de cacia y seguridad,

sean accesibles a la población y sistemas de salud locales.


Agradecimientos



Este artículo se ha realizado con apoyo del Programa «Estudios Sociales de la


Ciencia y la Tecnología», Universidad Nacional de Quilmes, del conicet (Argentina)



y del er c (283219) y esr c (ES/I018107/1) (Unión Europea). Un agradecimiento a


Mariano Fressoli por acompañar la fase inicial de esta investigación.


Notas


1. Las células madre pueden ser totipoten-
3. Rose
el biovalor como «los innu-



tes, si pueden desarrollarse en células de
merables modos en que la vitalidad se ha



cualquier especialización y encontrarse en
convertido en fuente potencial de valor»



cualquier tejido; multipotentes, si poseen
(Rose, 2012: 78). Waldby (2002) lo


limitada especialización y pueden encon-
como los modos en que los cuerpos y teji-


trarse en algunos tejidos; o unipotentes, si
dos se emplean para preservar y mejorar


pueden originar un solo tipo de células y
la salud y vitalidad de los vivos.


encontrarse en un solo tejido. Volver al texto
Volver al texto


2. El uso autólogo es el uso de células ma-
4. El proyecto fue
a través del Pro-


dre por la propia persona de la que se han
grama de Acción Estratégica (pae 37075):

obtenido. Se habla de un uso alogénico
«Estudio transversal y multidisciplinario


cuando la persona donante y la receptora
sobre la utilización terapéutica de célu-


son diferentes. Volver al texto
las madre
genéticamente»






























Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
(38-74)
67
| Page 31 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
(2006-2010). Este primer

para células madre implicó un

de 5,5 millones de pesos


asignados por la anpcyt a un consorcio


compuesto por nueve instituciones públi-


cas y privadas. Volver al texto

5. El
fue otorgado a dos ins-


tituciones por un monto de $7.999.994.

pl acema busca desarrollar y prestar ser-

vicios de reprogramación y diferenciación


celular a grupos de I+D y a la industria far-


macéutica. Volver al texto


6. Bajo esta iniciativa en 2011 se realizaron

convocatorias a Proyectos de Investiga-

ción
y Tecnológica (pict ) en

investigación básica (células madre em-

brionarias y reprogramadas) y traslacio-

nal (experimentos en modelos animales


para determinar la seguridad y


de intervenciones terapéuticas) así como


Proyectos de Investigación y Desarrollo

(pid) orientados a la investigación clíni-


ca de la aplicación de células madres.

Se priorizaron la investigación en enfer-

medades cardiovasculares, neurológicas

autoinmunes, óseas, relativas al cartíla-

go, diabetes y cáncer. Para los pict se


destinaron 2,9 millones de pesos argen-


tinos para los siete proyectos selecciona-


dos, mientras que para los pid se asignó

hasta un millón de pesos por proyecto.


Volver al texto

7. En 2010 la participación del gobierno en

el gasto de I+D en Argentina era del 73
%


versus el 22,3
% del sector privado. El pro
-


medio que se calcula para Iberoamérica


es del 47,5
% y 43,4
% respectivamente.

Fuente: r icyt (2010), http://www.ricyt.org.

Volver al texto

Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
8. Desde
de la década de 1980, la san-

gre de cordón umbilical se percibe como

una fuente valiosa de células progenito-

ras hematopoyéticas, consideradas una

fuente alternativa a la médula ósea y a la
sangre periférica en el tratamiento de di-
versas enfermedades hematológicas. Las
enfermedades degenerativas del sistema
nervioso se presentan como un blanco
atractivo para la terapia con células madre
de cordón (Innamorato y Argibay, 2005).
Volver al texto
9. En Brasil el tema de la utilización de cé-
lulas madre con
de investigación y

terapéuticos tuvo alta penetración en la

opinión pública. Esto se debió en parte al

alto
mediático que tuvo el primer en-

sayo clínico de tratamiento de fallas car-



díacas mediante inyección de células he-

matopoyéticas (2003) y el debate judicial

desarrollado hasta lograr la aprobación
de la investigación con células madre em-
brionarias (2008) (McMahon et al., 2010).
Volver al texto
10. El Banco Público de Sangre de Cordón
del Hospital Garrahan, creado en 2005,
forma parte de la Bone Marrow Donors
Worldwide, una red internacional que a
2008 ya reunía casi 300.000 unidades de
sangre de cordón, y más de 12 millones
de donantes voluntarios de médula ósea
(Stekolschik, 2008). Volver al texto
11. Entre los argumentos
que


sustentan esta posición se encuentran:


a) la incertidumbre sobre la duración de


las células de cordón criopreservadas; b)

la posibilidad de utilizar las células ma-

dre hematopoyéticas propias en caso de

necesidad (su probabilidad de utilización


















68
| Page 32 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
terapéutica se calcula en 1/20.000); c) la
recomendación de no utilizar las células
madre del propio paciente para tratarle
un cáncer o un desorden inmune, siendo
sólo aconsejable almacenar la sangre de
un hijo cuando en la familia hay otro niño
Referencias bibliog
cas

Ar gibay, P. (2005). Medicina regenerativa y


stem cells. De la terapia celular a la inge-
niería de tejidos. Bernal: Universidad Na-
cional de Quilmes Editorial.
Argentina, meca del turismo de salud trucho
(2009, 26 de septiembre), Diario
. Ob-

tenido el 15 de junio de 2015 de http://www.


-

mo-de-salud-trucho-20090926-0008.html

Ar zuaga, F. (2013), Stem Cell Research




and Therapies in Argentina: the Legal and


Regulatory Approach, en: Stem Cells De-


velopment, vol. 22 (1) :40-43.

Ar zuaga, F. (2014). Cuestiones éticas y nor-


mativas de las investigaciones y terapias


con células madre, en: Perspectivas Bioé-



ticas, (35-36) :79-88.


Bachr ach, P.; Bar at z, M.S. (1963). De-


cisions and nondecisions: An analytical



framework, en: American political science



review, 57(03) :632-642.



Beck, U. (1998) La sociedad del riesgo. Ha-


cia una nueva modernidad. Barcelona:



Paidós.


Bir ch, K. (2012) Knowledge, place, and pow-

er: geographies of value in the bioecono-

my, en: New Genetics and Society, 31(2):

183-201.

Br aga Menéndez, F. (2013). Presentación
en la Cumbre Mundial de Células Madre,
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
que tiene, o ha tenido, alguna de las en-
fermedades que hoy pueden tratarse con
trasplante de médula ósea y que, aun así,
sólo existe un 25
% de posibilidades de
compatibilidad (Stekolschik, 2008).
Volver al texto
San Diego, diciembre 2013 (testimonio).
Obtenido el 13 de mayo 2016 de https://
www.facebook.com/florencia.bragame-
nendez/posts/10152381064978210
Codner , D. (2011). Alcance, resultados e im-
pactos del f oncyt (pp. 129-176). En: Porta,
F.; Lugones, G. Investigación
e in-


novación tecnológica en Argentina. Impac-


to de los fondos de promoción Bernal: unq.


Comisión Asesor a en Ter apias Cel ul a-

r es y Medicina Regener at iva, MINCyT

[CACM-MINCyT]. (s.f.). Sitio web institu-

cional.
http://www.celulasmadre.mincyt.
gob.ar/index
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT]. (2009a). Investigación
y células madre: nociones para un deba-
te necesario. Obtenido el 15 de septiem-
bre de 2011 de http://www.mincyt.gob.ar/
multimedia/archivo archivos/INVESTIGA-
CION_Y_CELULAS_MADRE.pdf
Comisión Asesor a En Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT]. (2009b). Claves para el
debate sobre células madre. Obtenido el
15 de septiembre de 2011 de http://www.
mincyt.gob.ar/multimedia/archivo/archi-
vos/ CLAVES_PARA_EL_DEBATE_SO-
BRE_CELULAS_MADRE.pdf
















69
| Page 33 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT]. (2009c). Declaración
acerca de la guarda de células madre de
sangre de cordón umbilical. Obtenido el
15 de septiembre de 2011 de http://www.
mincyt.gob.ar/ multimedia/archivo/archi-
vos/DECLARACIN_CELULAS_MADRE_
CORDN_UMBILICAL.pdf
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT] (2009d). Recomendacio-
nes sobre el uso de células madre. Obte-
nido el 26 de enero de 2012
http://www.mincyt.gov.ar/noticias/noticias_
detalles.php?id_noticia=787
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT] (2011). Sobre la difusión
de Tratamientos con Células Madre. Ob-
tenido 26 de enero 2012 http://www.celu-
lasmadre.mincyt.gob.ar/ Documentos/So-
bre_la_difusion1.pdf
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT] (2012a, 25 de enero).
Células madre: sólo existen dos tratamien-
tos clínicamente aprobados. Obtenido el
26 de enero 2012 de http://www.mincyt.
gov.ar/noticias/noticias_detalles.php?id_
noticia=787
Comisión Asesor a en Ter apias Cel ul a-
r es y Medicina Regener at iva, MINCyT
[CACM-MINCyT] (2012b, 25 de enero). Lo
que hay que saber sobre las células ma-
dre. Obtenido el 26 de enero de 2012
http://www.mincyt.gov.ar/multimedia/
archivo/archivos/12-01-25_Cylulas_
Madre_lo_que_hay_que_saber.pdf
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
Con cél ul as madr e, consiguieron devol-
verles la visión a 10 pacientes (2014, 16 de
octubre), Clarín. Obtenido el 13 de mayo
de 2016 de http://www.clarin.com/socie-
dad/ celulas-consiguieron-devolverles-vi-
sion-pacientes_0_1231076946.html
CONICET (2012, 12 de octubre). Células
madre: «Van a ser una revolución en
medicina». CONICET. Obtenido el 15
de junio de 2015 http://www.conicet.gov.
ar/celulas-madre-van-a-ser-una-revolu-
cion-en-medicina/
Consor cio de Invest igación en Cél ul as
Madr e [CICEMA] (2009). Sitio web institu-
cional: www.cicema.org.ar.
Czubaj , F. (2015, 20 de enero). Murió Heleni-
ta, la beba que llegó al corazón del país. La
Nación. Obtenido el 13 d emayo de 2016 de
http://www.lanacion.com.ar/1761461-
murio-helenita-la-beba-que-llego-al-
corazon-del-pais
Dämmr ich, A. (2004) Pharmacopolitics. Drug
Regulation in the United States and Ger-
many. Chapel Hill: University of North Car-
olina Press.
Dumit, J. (2012). Drugs for life. How Phar-
maceutical Companies
Our Health.

Durham/London: Duke University Press.


El ust ondo, G. (2011, 19 de noviembre)

Guardar células madre no es egoísmo

sino protección biológica para hijos y fa-
milia. Clarín,
http://www.clarin.com/edicion-impresa/
Guardar-egoismo-proteccion-biologica-
familia_0_594540650.html
Feder ación Ar gent ina de Enf er medades
Poco Fr ecuent es (FADEPOF) (2014, 2
de noviembre). Informe sobre ensayo clí-
nico con células madres en pacientes con




























70
| Page 34 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
lesiones oculares. Obtenido el 13 de mayo
de 2016 http://fadepof.org.ar/noticias/53
Fer nandez, M. (2012, 29 de mayo). Sorat-
ti: No es más que un vil negocio. La Voz.
Obtenido el 15 de junio 2015 de http://www.
lavoz.com.ar/ciudadanos/soratti-no-es-
mas-que-vil-negocio
Fer r er as, A. (2012, 29 de mayo). Células
madres: China ofrece en Córdoba los tra-
tamientos. La Voz. Obtenido el 15 de junio
2015 de http://www.lavoz.com.ar/ ciudada-
nos/celulas-madres-china-ofrece-cordo-
ba-tratamientos
Fr essol i, M.; Bor t z, G. (2012) La construc-
ción social de las células madre como tec-
nología estratégica. Un análisis socio-téc-
nico del caso argentino. En: IX Jornadas
Latinoamericanas ESOCITE 2012, Méxi-
co, junio 2012.
Fr ost ; Sul l ivan (2014). Analysis of the
Global Stem Cell Market. Obtenido el 13 de
mayo de 2016 de http://www.frost.com/sub-
lib/display-report.do?id=P805-01-00-00-00
Fundación Inst it ut o Lel oir (FIL) (2014,
7 de enero). La Federación Argentina
de Enfermedades Poco Frecuentes rea-
lizó su evento de cierre en la FIL. FIL,
http://www.leloir.org.ar/blog/la-federa-
cion-argentina-de-enfermedades-po-
co-frecuentes-realizo-su-evento-de-cie-


Fur or sol idar io en l as r edes social es


por Hel enit a (2014, 18 de julio). Clarín.



Obtenido el 13 de mayo 2016 de http://www.


clarin.com/sociedad/Furor-solidario-re-


des-sociales-Helenita_0_1177082445.html

Gar au, J. (2015). Cuánto cuesta guardar

células madre en la Argentina, en: Re-
vista Apertura. Obtenido el 16 de mayo
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
de 2016 de http://www.apertura.com/tec-
no/
Cuanto-cuesta-guardar-celulas-ma-
dre-en-la-Argentina-20150610-0003.html
Gar cía, L. (2011, 18 de marzo) Argentina -

nanciará investigación con células madre.
SciDevNet. Obtenido el 9 de septiembre
de http://www.scidev.net/es/news/argenti-
n
nciar-investigaci-n-con-c-lulas-ma-


dre-.html

Gr and View Resear ch (2015). Stem Cells

Market Analysis By Product, By Technolo-

gy, By Application And Segment Forecasts
To 2020. Obtenido el 13 de mayo 2015 de
http://www.grandviewresearch.com/indus-
try-analysis/stem-cells-market
Gr eenwood, H. et al. (2006). Regenerative
Medicine and the Developing World. PLoS
Medicine, Vol. 3 (9), e381.
Gr ippo, A. (2013, 8 de noviembre). Células
madre para curar la desesperanza. Mate-
ria. Obtenido el 15 de junio 2015 de http://
esmateria.com/2013/11/08/celulas-ma-
dre-para-curar-la-desesperanza/?all=1
Hal l owel l , N.; Lawt on, J. (2002). Negoti-
ating present and future selves: managing
risk of hereditary ovarian cancer by pro-
phylactic surgery, en: Health (London), 6
(4) :423-443.
Har die, A. (2011). Stem cells revolutions
[documentary]. Nueva Zelanda.
Har mon, S.; Kal e, D. (2015). Regulating in
developing countries: Multiple roles for
medical research and products regulation
in Argentina and India, en: Technology in
Society, 43, :10-22.
Jasanof f, S.; Kim, S-H. (2009). Containing
the Atom: Sociotechnical Imaginaries and
Nuclear Power in the United States and
South Korea, en: Minerva, 47, :119–146.



























71
| Page 35 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
Kol at a, G. (2016, 28 de junio). Una adverten-
cia sobre la terapia con células madre. New
York Times. Obtenido el 30 de junio 2016
http://www.nytimes.com/es/2016/06/28/
una-advertencia-sobre-la-terapia-con-ce-
lulas-madre/
Kr mpot ic, C. (2011). Creer en la cura.
-

cia simbólica y control social en las prácti-

cas del Dr. M. en: Scripta Ethnologica, vol.

xxxiii, 97-116.

La obr a social no deber á cubr ir el t r a-
t amient o con células madres en tanto
carece de evidencias
que lo


respalden (2014, 25 de agosto). Microjuris.


Obtenido el 13 de mayo 2016 de https://


aldiaargentina.microjuris.com/2014/08/25/

la-obra-social-no-debera-cubrir-el-trata-

miento-con-celulas-madres-en-tanto-ca-

rece-de-evidencias-cienti
s-que-lo-res-

palden/

Las pr epagas t ambién deben cost ear l os

t r at amient os con células madre (2011, 19

de enero). Diario Judicial. Obtenido el 13
de mayo 2016 de http://www.diariojudicial.
com/nota/27164.
Levánt ense y anden (2015, 6 de noviem-
bre). Página 12. Obtenido el 13 de mayo
2016 de http://www.pagina12.com.ar/dia-
rio/sociedad/3-285563-2015-11-06.html
Mat t is, V. B.; Svendsen, C. N. (2011). In-
duced pluripotent stem cells: a new revolu-
tion for clinical neurology?, en: The Lancet
Neurology, 10(4), 383-394.
Mcmahon, D. S. (2014) The global industry
for unproven stem cell interventions and
stem cell tourism, en: Tissue Engineering
and Regenerative Medicine, 11(1), 1-9.
Mcmahon, D.S.; Singer , P.A.; Daar , A.S.;
Thor st einsdót t ir , H. (2010) Regenera-
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
tive medicine in Brazil: small but innovative,
en: Regenerative medicine, 5(6), 863-876.
Mcmahon, D.; Thor st einsdót t ir , H.
(2013). Pursuing endogenous high-tech in-
novation in developing countries: A look at
regenerative medicine innovation in Bra-
zil, China and India, en: Research Policy,
42(4), 965-974.
Mendizábal , V.; Gr ippo, A.; Ar zuaga, F.
(2014). Entre la cautela y la esperanza: el
papel de los
y expertos en la


comunicación de los riesgos asociados al


turismo de células madre, en: Perspecti-


vas Bioéticas, (35-36), 145-155.

Mimeaul t, M.; Hauke, R.; Bat r a, S. K.

(2007). Stem cells: a revolution in thera-

peutics-recent advances in stem cell biolo-

gy and their therapeutic applications in re-
generative medicine and cancer therapies,
en: Clinical Pharmacology & Therapeutics,
82(3), :252-264.
Minist er io de Ciencia, Tecnol ogía e Inno-
vación Pr oduct iva [MINCYT]. (2008, 15
de octubre). Se realizó la 2da conferencia
internacional sobre células madre. Obteni-
do el 10 de junio 2015 de http://www.mincyt.
gob.ar/noticias/se-realizo-la-2da-confe-
rencia-internacional-sobre-celulas-ma-
dre-4191
Minist er io de Ciencia, Tecnol ogía e In-
novación Pr oduct iva [MINCyT]. (2011a).
Plan Nacional de Ciencia, Tecnología e
Innovación 2012-2015. Construyendo Fu-
turo: Hacia una Argentina Innovadora (ver-
sión preliminar). Buenos Aires: MINCyT.
Minist er io de Ciencia, Tecnol ogía e In-
novación Pr oduct iva [MINCyT]. (2011b).
Documento de la Mesa de Trabajo: Cien-
cia, Tecnología e Innovación para la Sa-

















72
| Page 36 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
lud. En Conclusiones de las Mesas de Tra-
bajo para la elaboración del Plan Nacional
de Ciencia, Tecnología e Innovación 2012-
2015. Buenos Aires: MINCyT.
Minist er io de Ciencia, Tecnol ogía e In-
novación Pr oduct iva [MINCYT]. (2012).
Plan Nacional de Ciencia, Tecnología e
Innovación «Argentina Innovadora 2020».
Buenos Aires: MINCyT.
Minist er io de Ciencia, Tecnol ogía e Inno-
vación Pr oduct iva [MINCYT] (2012, 13
de junio). Se realizará el primer ensayo clí-
nico con células madre para el tratamiento
de ACV. MINCYT. Obtenido el 10 de junio
de 2015 de http://www.mincyt.gob.ar/noti-
cias/se-realizara-el-primer-ensayo-clini-
co-con-celulas-madre-para-el-tratamien-
to-de-acv-4519
Minist er io de Ciencia, Tecnol ogía e Inno-
vación Pr oduct iva [MINCYT] (2016, 12
de julio). Crece el debate sobre las tera-
pias avanzadas en la Argentina. MINCYT.
Obtenido el 13 de julio 2016 de http://www.
mincyt.gob.ar/noticias/crece-el-debate-so-
bre-las-terapias-avanzadas-en-la-argenti-
na-12164
Mor ando, L. (2006, 21 de diciembre). Sin
controles
ni aprobación


aplican en pacientes terapias con células


madre. Diario
. Obtenido el 15 de junio


2015 de http://www


Sin-controles-oficiales-ni-aprobacion-


cientifica-aplican-en-pacientes-terapias-



con-celulas-madre-20061221-0048.html


Novas, C. (2006) The Political Economy of

Hope: Patients’ Organizations, Science and

Biovalue, en: BioSocieties 1, :289–305.

Or ganización par a l a Cooper ación y

el Desar r ol l o Económicos [OCDE]


Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
(2006). The Bioeconomy to 2030: Design-
ing a Policy Agenda. Paris: ocde.
Padma, T.V. (2006) Unchecked by Guide-
lines, Indian Stem Cell Scientists Rush
Ahead, en: Nature Medicine,12(1), 4.
Pal ma, V., Pit ossi, F. J., Rehen, S. K., Tour -
iño, C.; Vel asco, I. (2015) Stem cell re-
search in Latin America: update, challenges
and opportunities in a priority research area,
en: Regenerative medicine, 10(06),: 785-798.
Pér ez, C. (2001). Technological change and
opportunities for development as a moving
target, en: Cepal Review, 75, :109–30
Pér ez, C.; Soet e, L. (1988). Catching up in
technology: entry barriers and windows of
opportunity (pp. 458-479). En: Dosi, G. et
al. (Eds.). Technical Change and Econom-
ic Theory, London: Francis Pinter.
Pit ossi, F. (2014, 1° de octubre), Esperan-
zas, desafíos y realidades de la medicina
regenerativa. Ciencia Hoy, 141, obtenido
de http://cienciahoy.org.ar/2014/10/espe-
-


cina-regenerativa



Roman, V. (2012, 14 de junio). El Incucai


ya autorizó tres ensayos sobre células



madre. Clarín. Obtenido el 15 de junio



2015 de http://www.clarin.com/sociedad/



Incucai-autorizo-ensayos-celulas-ma-


dre_0_718728219.html


Rose, N. (2012) Políticas de la vida: Biomedi-


cina, Poder y Subjetividad en el siglo xxi.


Buenos Aires: Unipe.

Rose, N.; Novas, C. (2004). Biological citi-


zenship (pp. 439-463). En; Ong, A.; Collier,

S., (Eds,) Global Assemblages: Technolo-

gy, Politics and Ethics as Anthropological

Problems, Ma. y Oxford, Reino Unido:

Blackwell Publishing.














































73
| Page 37 |
OPORTUNIDAD
(38-74)
BORTZ, GABRIELA et al. | ENTRE
Rosemann, A. (2014). Standardization as
achievement: Regulato-



ry diversity and the production of value in


intercontinental collaborations in stem cell



medicine, en: Social Science & Medicine,


122, :72-80.


Rosemann, A.; Bor t z, G.; Vasen, F.; Sl ee-

boom-Faul kner , M. (2016). Global regu-


latory developments for clinical stem cell

research:
and challenges to

collaborations, en: Regenerative Medici-


ne, 11(7), :647-657.

Se r eal izó con éxit o el t r aspl ant e de He-


l enit a (2014, 13 de septiembre). La Nación.


Obtenido el 13 de mayo de 2016 de http://

www.lanacion.com.ar/1726853-se-reali-



zo-con-exito-el-trasplante-de-helenita


Singer , E. (2008, 27 de agosto). A Stem-Cell

Revolution. MIT Review. Obtenido el 13 de
mayo de 2016 https://www.technologyre-
view.com/s/410750/a-stem-cell-revolution/
Sl eeboom-Faul kner , M.; Pat r a, P.K. (2008)
The bioethical vacuum: National policies
on human embryonic stem cell research in
India and China, en: Journal of internation-
al biotechnology law, 5(6), :221-234.
Sl eeboom-Faul kner , M. Chekar b, C.k.;
Faul kner , A; Heit meyer , C.; Mar oudab,
M.; Rosemann, A.; et al. (2016) Compar-
Ciencia, Docencia y Tecnología, 28 (54)
|
mayo de 2017
|
Y RIESGO. REGULACIÓN, EXPECTATIVAS Y POLÍTICAS CTI…
ing National Home-Keeping and the Reg-
ulation of Translational Stem Cell Appli-
cations: An International Perspective, en:
Social Science & Medicine, en prensa.
St ekol schik, G. (2008, junio) Las madres
de la ilusión, en: Revista EXACTAmente,
año 14, n.º 39. http://www.fcen.uba.ar/foto-
video/EXm/PDF/EXM39.pdf
St ekol schik, G. (2011, 10 de octubre) Cé-
lulas madre, en la línea de montaje. La
Nación. Obtenido de edición digital http://
www.lanacion.com.ar/1413327-celulas-
madre-en-la-linea-de-montaje
St ephens, N.; At kinson, P.; Gl anser , P.
(2011). Documenting the doable and doing
the documented: Bridging strategies at the
UK Stem Cell Bank, en: Social Studies of
Science, 41 (6), :791-813.
Tiwar i, S.s.; Raman, S. (2014) Governing
stem cell therapy in India: regulatory vac-
uum or jurisdictional ambiguity?, en: New
Genetics and Society, 33(4), :413-433.
Wal dby, C. (2002). Stem cells, tissue cul-
tures and the production of biovalue, en:
Health 6(3), :305-323.
Wal dby, C.; Mit chel l , R. (2006). Tissue
Economies: Blood, Organs, and Cell Lines
in Late Capitalism. Durham/London: Duke
University Press.










74