Respuestas - Capítulo III
Excepto por las preguntas de los apartados de Comprueba tu aprendizaje, sólo se dan las respuestas de los numerales impares
Comprueba tu aprendizaje
3.1 p2(V2 - V1)
3.2 Línea 1, ΔEint = 40 J; línea 2, W = 50 J y ΔEint = 40 J; línea 3, Q = 80 J y ΔEinte = 40 J; y la línea 4, Q = 0 y ΔEint = 40 J
3.3 Para que el proceso esté representado por la curva p = nRT/V en el gráfico pV para la evaluación del trabajo.
3,4 1,26 × 103 J.
Preguntas conceptuales
1. a. SE; b. ES; c. ES
3. Parte de la energía va a cambiar la fase del líquido a gas.
5. Sí, siempre que el trabajo realizado sea igual al calor agregado, no habrá cambios en la energía interna y, por lo tanto, no habrá cambios en la temperatura. Cuando el agua se congela o cuando el hielo se derrite al eliminar o agregar calor, respectivamente, la temperatura permanece constante.
7. Si se realiza más trabajo en el sistema que el agregado de calor, la energía interna del sistema disminuirá.
9. El sistema debe estar en contacto con una fuente de calor que permita que el calor fluya hacia el sistema.
11. Los procesos isotérmicos deben ser lentos para garantizar que, a medida que se transfiere el calor, la temperatura no cambie. Incluso para procesos isobáricos e isocóricos, el sistema debe estar en equilibrio térmico con cambios lentos de las variables termodinámicas.
13. Típicamente Cp es mayor que CV porque cuando la expansión ocurre bajo presión constante, trabaja en el entorno. Por lo tanto, el calor puede entrar en la energía interna y el trabajo. En un volumen constante, todo el calor entra en la energía interna. En este ejemplo, el agua se contrae al calentarse, por lo que si agregamos calor a presión constante, el trabajo se realiza en el agua por los alrededores y, por lo tanto, Cp es menor que CV.
15. No, siempre es mayor que 1.
17. Un proceso adiabático tiene un cambio en la temperatura pero no un flujo de calor. El proceso isotérmico no tiene cambios en la temperatura, pero tiene flujo de calor.
Problemas
19. p(V - b) = - cT es la escala de temperatura deseada y refleja el gas ideal si está bajo volumen constante.
21. V - bpT + cT2 = 0
23. 74 K
25. 1.4 veces
27. pVln(4)
29. a. 160 J; b. -160 J
31.
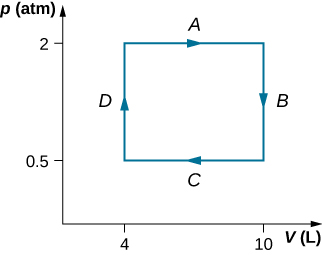
W = 900 J
33. 3.53 × 104 J
35. a. 1:1; b. 10:1
37. a. 600 J; b. 0; c. 500 J; d. 200 J; e. 800 J; f. 500 J
39. 580 J
41. a. 600 J; b. 600 J; c. 800 J
43. a. 0; b. 160 J; c. -160 J
45. a. -150 J; b. -400 J
47. No se realiza ningún trabajo y alcanzan la misma temperatura común.
49. 54,500 J
51. a. (p1 + 3V12)(V2 - V1) -3V1(V22 - V12) + (V23 - V13); b. (3/2)(p2V2 - p1V1); c. la suma de las partes (a) y (b); d. T1 = (p1V1)/nR y T2 = (p2V2)/nR
53. a.
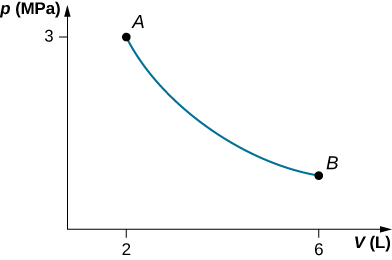
b. W = 4.39 kJ, ΔEint = -4.39 kJ
55. a. 1660 J; b. -2730 J; c. No depende del proceso.
57. a. 700 J; b. 500 J
59. a. -3400 J; b. 3400 J ingresa al gas
61. 100 J
63. a. 370 J; b. 100 J; c. 500 J
65. 850 J
67. la presión disminuyó en 0.31 veces la presión original
69.
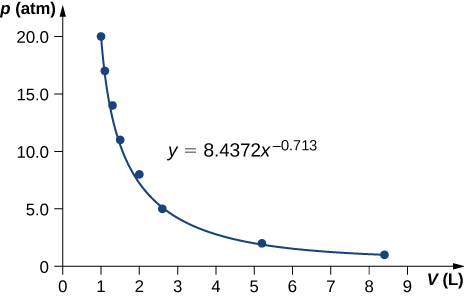
γ = 0.713
71. 84 K
73. Una expansión adiabática tiene menos trabajo y no hay flujo de calor, por lo tanto, una energía interna menor en comparación con una expansión isotérmica que tiene tanto flujo de calor como trabajo realizado. La temperatura disminuye durante la expansión adiabática.
75. La Isoterma tiene una mayor presión final y no depende del tipo de gas.
77.

Problemas Adicionales
79. a. WAB = 0, WBC = 2026 J, WAD = 810.4 J, WDC = 0; b. ΔEAB = 3600J, ΔEBC = 374J; c. ΔEAC = 3974 J; d. QADC = 4784 J; e. No, porque se agregó calor para ambas partes, AD y DC. No hay suficiente información para determinar cuánto es de cada segmento de la trayectoria.
81. 300 J
83. a. 59,5 J; b. 170 N
85. 2.4 × 103 J
87. a. 15,000 J; b. 10,000 J; c. 25,000 J
89. 78 J
91. Un cilindro que contiene tres moles de gas nitrógeno se calienta a una presión constante de 2 atm. a. -1220 J; b. +1220 J
93. a. 7,6 L, 61,6 k; b. 81.3 K; c. 3.63 L•atm = 367 J; d. -367 J
Problemas Desafío
95. a. 1700 J; b. 1200 J; c. 2400 J
97. a. 2.2 mol; b. VA = 2.6 × 10−2 m3, VB =7.4 × 10−2 m3; c. TA = 1220 K,TB = 430 K; d. 30,500 J



