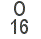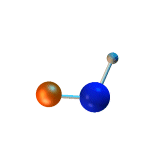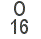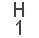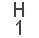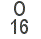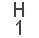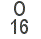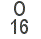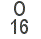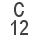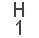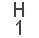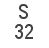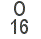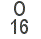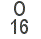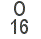Ejercicios resueltos de masas moleculares
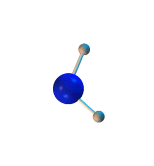
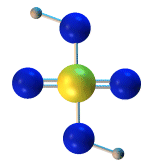
La suma de las masas atómicas de los átomos que forman una molécula es la masa molecular. Normalmente se miden en Unidad de Masa Atómica (uma). Por ejemplo, la masa atómica del hidrógeno es de 1 uma, la del oxígeno 16 uma y por tanto la masa molecular del agua es de 18 uma.
Para calcular la masa molecular basta sumar la masa atómica de los átomos de la molécula, masa atómica que aparece en la tabla periódica, siempre medida en uma.