|
Las disoluciones de algunas sales llamadas neutras (que no contienen H ni OH) en su composición, contrariamente a lo que se podría suponer a primera vista, presentan carácter ácido o básico. Por ejemplo, cuando se disuelve carbonato sódico o acetato sódico puede comprobarse que la disolución resultante no es neutra sino básica.
Este comportamiento ácido o básico de las disoluciones de algunas sales se debe a que, al menos, uno de los iones de la sal reacciona con el agua rompiéndola en un proceso denominado hidrólisis.
Por ejemplo uno de los iones resultantes de la disolución podría ser una base más fuerte que el agua, en este caso:
B- |
+ |
H2O |
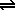 |
OH- |
+ |
HB |
| Base1 |
|
Ácido2 |
|
Base2 |
|
Ácido1 |
Vemos que la disolución resultante tendría carácter básico.
|


